рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Концентрація розчиненої речовини
Реферат Курсовая Конспект
Концентрація розчиненої речовини
Концентрація розчиненої речовини - раздел Химия, «РОЗЧИНИ» для студентів I курсу Концентрація - Одне Із Важливих Понять У Теорії Розчині...
Концентрація - одне із важливих понять у теорії розчинів. Під концентрацією розуміють кількісну оцінку вмісту речовини (компонента) в системі.
На практиці найчастіше використовують такі способи вираження концентрації: масова доля, молярна доля, об'ємна доля, масова концентрація, молярна концентрація, моляльність, еквівалентна молярна концентрація (раніше називалась нормальна концентрація).
Розглянемо деякі способи вираження концентрації розчиненої речовини:
І)масова доля ω(Х) - безрозмірне відношення маси компоненту m(Х) до маси розчину ( Х – формульне позначення частки речовини):
 ;
; 
Приклад. Обчислити масову долю NaCl, якщо відомо, що 20 г хлориду натрію розчинено у 180 г води.
Рішення:
 або 10%
або 10%
2)молярна доля N(Х) - відношення кількості речовини компонента  до загальної кількості речовини всіх компонентів розчину:
до загальної кількості речовини всіх компонентів розчину:
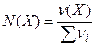 ,
,
де:  m(X) – маса компонента (X);
m(X) – маса компонента (X);
M(X) – молярна маса компонента (X).
Приклад. Обчислити молярну долю глюкози у розчині, одержаному при розчиненні 18 г глюкози у 180 г води.
Рішення: 

 Цей спосіб вираження концентрації широко використовується при термодинамічних розрахунках.
Цей спосіб вираження концентрації широко використовується при термодинамічних розрахунках.
3)масова концентрація T(X)– відношення маси компонента т(X) до об'єму розчину (раніше називалась титр розчину):

Приклад. У 200 мл розчину знаходиться 10 г хлориду натрію. Обчислити масову концентрацію розчину.
Рішення: 
4)молярна концентрація С(Х) - відношення кількості речовини компонента до об'єму розчину

Приклад. У 500 мл розчину знаходиться 10,6 г Na2CO3.
Обчислити молярну концентрацію розчину.
Рішення:
5)молярна концентрація еквівалента СЕ(Х) (еквівалентна концентрація) - це відношення еквівалентної кількості розчиненої речовини до об'єму розчину.
 де Еm(Х) – молярна маса еквівалента розчиненої речовини. Величину Z* називають числом(фактором) еквівалентності. Число еквівалентності для елемента дорівнює його валентності в сполуці, для кислоти - основності, для основи - кислотності, або валентності металу; для речовин, які беруть участь в окисно-відновних реакціях - числу електронів, які приймають або віддають атоми окислювача або відновника.
де Еm(Х) – молярна маса еквівалента розчиненої речовини. Величину Z* називають числом(фактором) еквівалентності. Число еквівалентності для елемента дорівнює його валентності в сполуці, для кислоти - основності, для основи - кислотності, або валентності металу; для речовин, які беруть участь в окисно-відновних реакціях - числу електронів, які приймають або віддають атоми окислювача або відновника.
Приклад. У 200 мл розчину знаходиться 4,9 г сірчаної (сульфатної) кислоти. Обчислити молярну концентрацію еквівалентів сульфатної кислоти.
Рішення.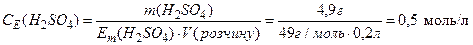
Між об'ємом розчину і його молярною концентрацією еквівалента існує обернено пропорційна залежність:

За цією залежністю можна не тільки обчислювати об'єми розчинів, потрібні для проведення реакцій, а й за об'ємами розчинів, що беруть участь у реакції, знаходити їхні концентрації.
6)моляльна концентрація (моляльність розчину)Сm(Х) - це відношення кількості розчиненої речовини до маси розчинника (кг). Вона показує кількість молів розчиненої речовини, що припадає на 1 кг розчинника:

Приклад. 18 г глюкози розчинено у 500 г води. Розрахувати моляльність одержаного розчину.
Рішення: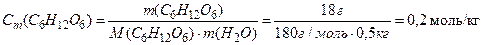 Моляльність використовують при фізико-хімічних дослідженнях розчинів, наприклад, при кріоскопічних та ебуліоскопічних визначеннях.
Моляльність використовують при фізико-хімічних дослідженнях розчинів, наприклад, при кріоскопічних та ебуліоскопічних визначеннях.
– Конец работы –
Эта тема принадлежит разделу:
«РОЗЧИНИ» для студентів I курсу
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... Кафедра хімії... МЕТОДИЧНІ ВКАЗІВКИ РОЗЧИНИ для студентів I курсу...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Концентрація розчиненої речовини
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов