рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Термохімія.
Реферат Курсовая Конспект
Термохімія.
Термохімія. - раздел Химия, Енергетика і напрямленість хімічних процесів Теплові Ефекти Хімічних Процесів Вивчає Термохімія. При Розрахунках Використо...
Теплові ефекти хімічних процесів вивчає термохімія. При розрахунках використовуються стандартні теплові ефекти 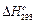 , тобто визначені за стандартних умов (за температури 298,15 К і тиску 101,3 кПа). Рівняння реакцій, в яких зазначено тепловий ефект, а також агрегатний стан речовин, називають термохімічними. З такими рівняннями можна виконувати ті ж дії, що і з алгебраїчними (складати, віднімати, помножувати на коефіцієнт тощо).
, тобто визначені за стандартних умов (за температури 298,15 К і тиску 101,3 кПа). Рівняння реакцій, в яких зазначено тепловий ефект, а також агрегатний стан речовин, називають термохімічними. З такими рівняннями можна виконувати ті ж дії, що і з алгебраїчними (складати, віднімати, помножувати на коефіцієнт тощо).
Усі термохімічні розрахунки базуються на двох законах термохімії.
Перший закон термохімії – закон Лавуазьє і Лапласа (1760) формулюється так: Тепловий ефект утворення хімічної сполуки дорівнює тепловому ефекту розкладання цієї сполуки тільки із зворотним знаком.
Наприклад, при утворенні 1 моль води із водню і кисню виділяться 241,8 кДж/моль.
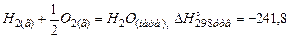 кДж/моль
кДж/моль
Таку саму енергію треба затратити, щоб розкласти 1 моль пароподібної води на водень і кисень, тобто
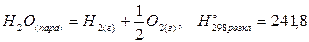 кДж/моль
кДж/моль
Теплота утворення – це тепловий ефект реакції утворення 1 моль даної сполуки з простих речовин, найстійкіших за даних умов.
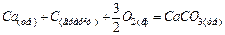 ,
, 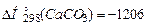 ,0 кДж/моль
,0 кДж/моль
Теплота утворення, віднесена до 1 моль речовини за температури 298 К і тиску 101 кПа (760 мм рт. ст.), називається стандартною теплотою утворення і позначається 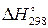 .
.
Значення стандартних теплот утворення багатьох хімічних сполук визначені й зведені в таблиці термодинамічних величин і наводяться в довідниках.
Теплота утворення (ентальпія утворення) простих речовин у стійкому стані за стандартних умов має нульове значення. Наприклад, 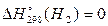 ,
,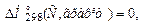
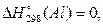
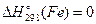 .
.
Другий закон термохімії – закон Гесса (основний закон термохімії) (1840) формулюється так: Тепловий ефект хімічної реакції не залежить від характеру й послідовності її стадій, а визначається лише початковими і кінцевими продуктами реакції та їх фізичним станом (при V=const або P=const).
Наприклад, при згорянні 1 моль графіту з утворенням вуглекислого газу (СО2) виділяється 393,0 кДж теплоти. Якщо процес провести через проміжну стадію з утворенням СО і подальшим його згорянням до СО2, то в першому випадку (утворення СО) виділяється 110,5 кДж теплоти, а в другому (утворення СО2 з СО) виділяється 282,5 кДж.
Із цього прикладу видно, що сума теплових ефектів проміжних реакцій (110,5+282,5=393,0 кДж/моль) дорівнює тепловому ефекту прямої реакції.
Примітка: Закон Гесса застосовують до процесів, що відбуваються при постійному об’ємі або при постійному тиску.
Наслідки із закону Гесса:
1.Тепловий ефект хімічної реакції ΔНох.р. дорівнює сумі теплот утворення продуктів реакції мінус сума теплот утворення вихідних речовин. Тобто для реакції
аА+вВ=сС+dD (3)
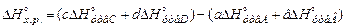 (4)
(4)
Приклад. Визначити тепловий ефект 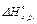 реакції Al2O3+3SO3=Al2(SO4)3, якщо відомо, що
реакції Al2O3+3SO3=Al2(SO4)3, якщо відомо, що 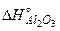 = -1675 кДж/моль;
= -1675 кДж/моль; 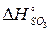 = -395 кДж/моль;
= -395 кДж/моль; 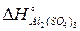 = -3434 кДж/моль.
= -3434 кДж/моль.
Розв’язання. Згідно з рівнянням (4) маємо
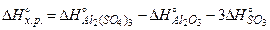 =-3434+1675+3·395,2=-553,4кДж
=-3434+1675+3·395,2=-553,4кДж
2.Тепловий ефект хімічної реакції ΔНх.р. дорівнює сумі теплот згорання вихідних речовин мінус сума теплот згорання продуктів реакції. Тобто для реакції(3)
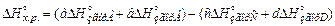 (5)
(5)
Стандартною теплотою (ентальпією) згоряння називається тепловий ефект реакції окислення 1 моль даної сполуки в атмосфері кисню до утворення вищих оксидів елементів, які входять до її складу, за стандартних умов. Значення стандартної ентальпії згоряння також можна найти в термодинамічних таблицях.
Із закону Гесса витікає ще кілька наслідків:
- якщо здійснюються дві реакції, які приводять із різних початкових станів до однакових кінцевих станів, то різниця теплових ефектів дорівнює тепловому ефекту переходу з одного початкового стану в другий;
- якщо здійснюються дві реакції, які приводять із однакових початкових станів до різних кінцевих станів, то різниця між їхніми тепловими ефектами дорівнює тепловому ефекту переходу з одного кінцевого стану в другий.
Таким чином, застосовуючи закон Гесса, можна обчислити теплові ефекти окремих реакцій, особливо проміжних стадій, які експериментальним шляхом визначити неможливо.
У термохімії визначають й інші теплові ефекти: теплоту розчинення, теплоту нейтралізації, теплоту плавлення та ін.
Теплота розчинення.
Багато хімічних реакцій перебігає у розчинах, і їх тепловий ефект залежить не тільки від енергії хімічної взаємодії самих речовин, але і від теплоти їх розчинення в розчиннику.
Теплота розчинення твердої речовини в основному є сумою двох величин: теплоти руйнування кристалічної решітки (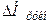 >0) та теплоти сольватації іонів молекулами розчинника (
>0) та теплоти сольватації іонів молекулами розчинника (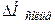 <0):
<0):
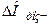 =
=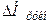 +
+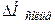
Знак сумарного теплового ефекту залежатиме від того, який із цих доданків більший за абсолютною величиною.
У залежності від того, розчиняється речовина в чистому розчиннику чи в розчині певної концентрації, розрізнюють інтегральні і диференціальні теплоти розчинення.
Інтегральною теплотою розчинення називається тепловий ефект розчинення 1 моля речовини в такій кількості розчинника, щоб отримати розчин заданої концентрації. Якщо при розчиненні утворюється нескінченно розбавлений розчин, то тепловий ефект розчинення називають першою інтегральною теплотою розчинення 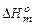 . Практично її визначають екстраполяцією концентраційної залежності інтегральної теплоти розчинення на нульову концентрацію. У разі утворення насиченого розчину йдеться про повну (останню) інтегральну теплоту розчинення.
. Практично її визначають екстраполяцією концентраційної залежності інтегральної теплоти розчинення на нульову концентрацію. У разі утворення насиченого розчину йдеться про повну (останню) інтегральну теплоту розчинення.
Диференціальною (парціальною мольною) теплотою розчинення 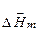 називається тепловий ефект розчинення 1 моля речовини у нескінченно великій кількості розчину цієї речовини заданої концентрації.
називається тепловий ефект розчинення 1 моля речовини у нескінченно великій кількості розчину цієї речовини заданої концентрації.
Теплота нейтралізації.
Теплота нейтралізації - тепловий ефект, який спостерігається при нейтралізації одного моль еквівалента кислоти одним моль еквівалента гідроксиду в розведених водних розчинах.
При взаємодії 1моль еквівалента сильної кислоти з 1моль еквівалента сильного гідроксиду в розведених водних розчинах виділяється майже однакова кількість теплоти
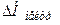 = -55,9 кДж/моль (при 298 К).
= -55,9 кДж/моль (при 298 К).
Розглянемо для прикладу реакцію нейтралізації сильної кислоти сильною основою (лугом):
НС1 + NaOH = NaC I + Н2О,
або в іонній формі:
Н+ + Сl-+ Na+ + ОН-= Na+ + Сl-+ Н2О.
Після скорочення одержимо:
Н+ + ОН-= Н2О; 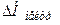 = -55,9 кДж/моль.
= -55,9 кДж/моль.
Сталість теплот нейтралізації пов'язана з тим, що при взаємодії будь-якої сильної кислоти з будь-якою сильною основою, повністю дисоційованими у водних розчинах, у всіх випадках протікає однакова реакція: з іонів Н+ кислоти і іонів ОН-гідроксиду утворюються молекули води. Зрозуміло, що однаковим реакціям відповідає й однаковий тепловий ефект.
Нейтралізація слабких кислот сильними основами або сильних кислот слабкими основами супроводжується одночасно дисоціацією слабкого електроліту. При цьому виділяється або поглинається теплота дисоціації 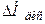 , яка залежить від кількості теплоти, що поглинається при розпаді молекул слабкого електроліту на іони й теплоти сольватації іонів слабкого електроліту молекулами розчинника. Залежно від того, яка теплота з двох названих буде більшою, теплота дисоціації може бути додатною або від'ємною. Таким чином, теплота нейтралізації слабких кислот і гідроксидів складається із теплоти утворення води з іонів Н+ і ОН-(-55,9 кДж/моль) і теплоти дисоціації слабкого електроліту
, яка залежить від кількості теплоти, що поглинається при розпаді молекул слабкого електроліту на іони й теплоти сольватації іонів слабкого електроліту молекулами розчинника. Залежно від того, яка теплота з двох названих буде більшою, теплота дисоціації може бути додатною або від'ємною. Таким чином, теплота нейтралізації слабких кислот і гідроксидів складається із теплоти утворення води з іонів Н+ і ОН-(-55,9 кДж/моль) і теплоти дисоціації слабкого електроліту 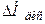 :
:
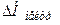 = -55,9 +
= -55,9 + 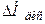 .
.
Теплоємність.
Загальна теплоємність системи — це кількість теплоти, яка потрібна для підвищення температури системи на один градус. Оскільки вона є величиною екстенсивною, то більш зручно користуватися теплоємністю, віднесеною до одиниці кількості речовини. В залежності від цього розрізняють питому (на 1 г чи 1 кг маси речовини) та мольну (на 1 моль) теплоємності. Їх величини залежать також від умов нагрівання — СV (при V = const) та Ср (р = const). Теплоємність залежить від природи речовини, а також від температури, тому розрізняють середню теплоємність 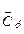 (чи
(чи 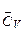 ) у заданому інтервалі температур (від Т1 до Т2) та істинну теплоємність Ср (або СV) при заданій температурі Т. Середня теплоємність
) у заданому інтервалі температур (від Т1 до Т2) та істинну теплоємність Ср (або СV) при заданій температурі Т. Середня теплоємність
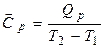 ;
; 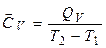 .
.
а істинна теплоємність
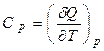 ;
; 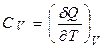
Середня теплоємність наближається до істинної (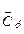 →Cр) при зменшенні температурного інтервалу, коли (Т2— Т1) —> 0. Для 1 моль ідеального газу Cр = CV +R (рівняння Майєра). Робота розширення 1 моль ідеального газу в різних процесах розраховується за формулами:
→Cр) при зменшенні температурного інтервалу, коли (Т2— Т1) —> 0. Для 1 моль ідеального газу Cр = CV +R (рівняння Майєра). Робота розширення 1 моль ідеального газу в різних процесах розраховується за формулами:
| Ізобарний процес (p=const) | Ізохорний процес (V=const) | Ізотермічний процес (T=const) | Адіабатичний процес (δQ=0) |
| Ap=p(V2 - V1) pV=RT Wp=R(T2 - T1) | dV=0 AV=0 | AT= RT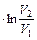 ; AT= RT ; AT= RT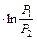
| δA=-dU; CV=dU/dT; dU= CV∙dT; δAQ=- CV∙dT; AQ= CV∙(T1 - T2); |
Температурну залежність Cр звичайно представляють у вигляді емпіричних рівнянь типу
Cр = а +bТ + cT 2 ; Cр = а +bТ + c′ T -2
та інших. У довідкових таблицях наводяться значення коефіцієнтів a, b, c, c′… та інтервал температур, для якого виправдовуються ці залежності.
Залежність теплового ефекту хімічних реакцій від температури описується рівнянням К.Кірхгофа в диференціальній
(d∆Hp/dT)p = ∆Cp та інтегральній 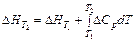 формах.
формах.
– Конец работы –
Эта тема принадлежит разделу:
Енергетика і напрямленість хімічних процесів
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термохімія.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов