Часть I
МИНИСТЕРСТВО ОБРАЗОВАНИЯ
И НАУКИ УКРАИНЫ
КРИВОРОЖСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра химии
H2SO4 NaCl
Fe2O3 NaOH
H2O
CoOHCl
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к практическим занятиям по химии
для иностранных студентов
подготовительного отделения
(дополненное и переработанное издание)
Часть I
РОЗГЛЯНУТО СХВАЛЕНО
на засіданні кафедри хімії на вченій раді
металургійного факультету
Протокол №_1___ Протокол № __1_____
від __31.08___________2007 р. від ___31. 08.__________2007 р.
С о д е р ж а н и е.
2. Второе занятие. Тема: Вещества и их формулы. Состав вещества …………………………………………………………….6Первое занятие
Тема: Химические элементы и их символы.
Элемент, химический элемент, название элемента, символ, символ элемента, знак,… Символы некоторых химических элементов: Символ элемента Чтение символа Латинское …Fe, Cu, O, H, Hg, S, Mn, Ca, Ag, Cl, Zn, Br, F, I, P
Укажите, где находятся эти элементы в таблице
Менделеева (группа, период).
Второе занятие
Тема: Вещества и их формулы. Состав вещества.
Ключевые слова и словосочетания:
Вещество, состав вещества, атом, молекула, формула вещества, количество молекул, индекс, коэффициент, количество атомов в молекуле
Прочитайте слова и словосочетания:
1. Символ, элемент, химический элемент, символ химического элемента, химия.
2. Атом, молекула, вещество, молекула вещества.
3. Формула, формула молекулы, формула молекулы вещества.
4. Таблица химических элементов Менделеева.
5. Один атом, два атома, три атома, пять атомов, одна молекула, состоит из молекул, состоит из атомов;
6. Дважды, трижды.
Прочитайте текст:
Вещество состоит из молекул. Молекула состоит из атомов. Формулы обозначают молекулы вещества. Формула показывает, какие элементы и сколько атомов элементов содержится в молекуле вещества.
Например:1) Формула вещества H2O показывает, что молекула вещества состоит из двух атомов водорода и одного атома кислорода. Формулу читаем - [аш два о]. Вещество называется – вода.
2) Формула молекулы вещества Н2 показывает, что молекула состоит из двух атомов водорода.
Формулу читаем - [аш два]. Вещество называется водород.
3)Формула вещества НCI показывает, что молекула состоит из атома водорода и атома хлора. Читаем формулу [аш хлор]. Вещество называется хлоридная кислота.
4) Индекс возле элемента 2, 3, 4 - читаем: два, три, четыре; индекс за скобками читаем – дважды, трижды.
Например: AI2O3 читаем - [алюминий два о три], AI(OH)3 читаем - [алюминий о аш трижды].
Задание 1.Ответьте на вопросы:
1. Что обозначают формулы?
2. Что показывает формула?
3. Что показывает формула вещества воды?
4. Что показывает формула вещества водорода?
5. Что показывает формула вещества хлоридной кислоты?
6. Как читаем индекс возле элемента?
7. Как читаем индекс за скобками?
Задание 2:Читайте формулы веществ. Ответьте на вопрос: атомы каких элементов и сколько их содержится в молекуле вещества? Запишите в тетрадь название и формулу вещества:
CaO - оксид кальция; AlCl3- хлорид алюминия;
NaCl - хлорид натрия; H2SO4- серная кислота;
H3PO4 - фосфорная кислота; СО2- оксид углерода;
CuO- оксид меди; Fe(OH)3 - гидроксид железа.
Задание 3:Слушайте преподавателя и пишите формулы:
Например: [аш три пэ о четыре]- пишем формулу H3PO4
[цэ о два]- пишем формулу CO2
Диктант: 1. [аш эн о три];
2. [пэ два о пять];
3. [купрум хлор два];
4. [эс о три];
5. [кобальт эн о три дважды];
Домашнее задание: Напишите ответы на вопросы:
1. Сколько атомов и каких элементов содержится в молекуле карбоната кальция CaCO3?
2. Атомов какого элемента больше всего в молекуле серной кислоты?
3. Назовите вещества: SO2 ; FeCl3 ; NiO. Атомы каких элементов содержатся в молекулах этих веществ?
4. Напишите формулы веществ: [натрий два о], [феррум два о три], [барий хлор два], [эс о три], [купрум о аш дважды], [феррум о аш трижды].
Третье занятие
Тема: Простые и сложные вещества.
Вещество, молекула, простое вещество – простые вещества, молекула простого вещества, сложное вещество – сложные вещества, молекула сложного… Прочитайте текст и выполните задания 1 и 2:Металлы Неметаллы
Fe - железо S- сера
Cu - медь O2 - кислород
Ag - серебро P - фосфор
Na - натрий Cl2 - хлор
Pb - свинец C– графит (алмаз)
и другие и другие
Элементы, которые образуют простые вещества Неметаллы, в таблице Менделеева занимают группы:
IIIa IVa Va VIa VIIa VIIIa
Н He
B C N O F Ne
Si P S Cl Ar
As Se Br Kr
Te I Xe
At Rn
Атомы остальных элементов образуют простые вещества Металлы.
Задание 1: Ответьте на вопросы:
1) Какие вещества называются простыми?
2) Какие вещества называются сложными?
3) На какие вещества делятся простые вещества?
Задание 2: Напишите в тетради формулы веществ. Ответьте на вопрос: какое это вещество – простое или сложное?
Fe2O3 ; Cu(OH)2 ; CoCl2 ; H3PO4 ; Ag ; S ; CO2 ; Cl2 ; I2 ; O3 .
Модель ответа: O2 – это простое вещество, потому что молекула состоит из атомов одного элемента - кислорода. Это неметалл. SO2 - оксид серы – это сложное вещество, так как молекула состоит из атомов разных химических элементов- атомов серы и…Четвертое занятие
Тема: Основные классы неорганических веществ.
Ключевые слова и словосочетания:
Органическое вещество, неорганическое вещество, основной класс, оксид – оксиды, основание – основания, кислота – кислоты, соль – соли, свойства вещества, химические свойства, реакция, взаимодействие, взаимодействовать, исходное вещество, продукт реакции, основный оксид, кислотный оксид, амфотерный оксид, гидрат, гидрат оксида, ион, заряд иона, катион, анион, положительный заряд, отрицательный заряд, условный заряд.
Прочитайте текст и выполните задания 1 и 2:
Текст:
Сложные неорганические вещества делят на четыре основных класса:
Оксиды
Основания
Кислоты
Оксиды – это сложные вещества. Их молекулы состоят из атомов двух элементов, один из которых кислород. Условный заряд кислорода в оксидах всегда… Название оксида: слово оксид + название элемента (чего?).Пятое занятие
Тема: Основные классы неорганических веществ (продолжение).
Ключевые слова и словосочетания:
Гидроксид, гидроксид-ион, остаток, кислотный остаток, ион, катион, анион, кислота, основание, частица.
Прочитайте текст и выполните задания 1 и 2:
Текст: Ионы – это частицы, имеющие реальный заряд. Катионы– это ионы с положительным зарядом (K+ , Ca2+, H+, NH4+, BiOH2+). Анионы – это ионы с отрицательным зарядом (OH- , Cl-, SO42-, PO43-).
Основания –это сложные вещества. Их молекулы состоят из катионов металла и аниона ОН-. Он называется гидроксид-ион и имеет заряд минус один (-1).
Название основания:слово гидроксид + название элемента (чего?).
Например: NaOH [натрий о аш]– гидроксид натрия;
Fe(OH)3 [феррум о аш трижды]– гидроксид железа (III).
Кислоты – это сложные вещества. Их молекулы состоят из катионов водорода и аниона - кислотного остатка.
Например: HCl à H+ +Cl- ; Cl- - хлорид-ион - кислотный остаток.
хлоридная
кислота
H2SO4 à 2H+ + SO42- ; SO42- – сульфат-ион - кислотный
сульфатная кислота остаток
Кислота называется по названию кислотного остатка или по названию центрального атома.
Кислотный остаток: Кислота:
PO4 3 - - фосфат H3PO4 – фосфатная кислота
(фосфорная кислота)
SO4 2 - - сульфат H2SO4 – сульфатная кислота
(серная кислота)
NO3 - - нитрат HNO3 - нитратная кислота
(азотная кислота)
NO2- - нитрит HNO2 –нитритная кислота
(азотистая кислота)
Сl - - хлорид HCl- хлоридная кислота
(хлороводородная кислота)
SO3 2 - - сульфит H2SO3 – сульфитная кислота
(сернистая кислота)
S 2- - сульфид H2S- сульфидная кислота
(сероводородная кислота
CO3 2 - - карбонат Н2СО3 – карбонатная кислота
(угольная кислота)
SiO3 2- - cиликат H2SiO3 – силикатная кислота
(кремниевая кислота)
Соли –это сложные вещества. Их молекулы состоят из катиона металла (или другого катиона) и кислотного остатка.
Название соли :сначала название кислотного остатка, а потом название катиона (чего?).
Например:
 [калий три пэ о четыре]- фосфат калия;
[калий три пэ о четыре]- фосфат калия;
 [эн аш четыре хлор]- хлорид аммония;
[эн аш четыре хлор]- хлорид аммония;
Al(NO3)3 [алюминий эн о три трижды] – нитрат алюминия.
 [феррум два эс о четыре трижды]- сульфат железа(III) – в скобках указывается заряд катиона, если элемент может иметь разные заряды.
[феррум два эс о четыре трижды]- сульфат железа(III) – в скобках указывается заряд катиона, если элемент может иметь разные заряды.
Соли - это продукты реакции кислоты с основанием. Эта реакция называется реакция нейтрализации:
Например:

основание + кислотаà вода + соль
 – хлорид натрия.
– хлорид натрия.
Ca(OH)2 + H2SO4 =2H2O +CaSO4
основание + кислота -= вода + соль
CaSO4 - сульфат кальция
Соли делят на:
а) нормальные (средние);
б) кислые;
в) основные.
Соли средние или нормальные не содержат ионов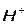 или
или  -полная нейтрализация кислоты и основания.
-полная нейтрализация кислоты и основания.
Например: KOH + HNO3 = KNO3 + H2O
Соли кислые, если в составе кислотного остатка есть 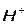 - неполная нейтрализация кислоты ( кислоты больше, чем основания):
- неполная нейтрализация кислоты ( кислоты больше, чем основания):
Например: 1 KOH +1 H2SO4 = KHSO4 + H2O
Ca(OH)2 + 2H2CO3 = Ca(HCO3)2 + 2H2O
KOH + 1H3PO4 = KH2PO4 + H2O
 - гидросульфат калия. Кислотный остаток
- гидросульфат калия. Кислотный остаток  - называется гидросульфат (гидро - водород);
- называется гидросульфат (гидро - водород);
Ca(HCO3)2 - гидрокарбонат кальция;
КН2РО4 – дигидрофосфат калия ( ди – два)
Основные соли содержат  - (гидроксо-ион) в составе катиона – неполная нейтрализация основания (основания больше, чем кислоты).
- (гидроксо-ион) в составе катиона – неполная нейтрализация основания (основания больше, чем кислоты).
Например: 1Cu(OH)2 +1 HCl = CuOHCl + H2O
Fe(OH)3 + 1H2SO4 = FeOHSO4 + 2H2O
Al(OH)3 + 1 HNO3 = Al(OH)2 NO3 + H2O
CuOHCl -хлорид гидроксомеди (II);
FeOHSO4 - сульфат гидроксожелеза (III);
Al(OH)2NO3 - нитрат дигидроксоалюминия (ди-два).
Соли можно получить и при взаимодействии:
а) Основный оксид + кислота = соль + вода
б) Кислотный оксид + основание = соль + вода
в) Основный оксид + кислотный оксид = соль
г) Амфотерный оксид + кислота = соль + вода
д) Амфотерный оксид + основание = соль + вода
Задание 1: Назовите вещества и укажите, к какому классу они относятся:
 ;
; ;
; 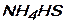 ;
;  ;
; 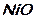 ;
;  ;
;  ;
;  ;
; ; СоОНСl.
; СоОНСl.
Задание 2: Напишите формулы веществ и укажите, к какому классу относятся эти вещества:
а) гидроксид железа (III); б) сульфат гидроксомеди (II);
в) оксид алюминия; г) гидрофосфат алюминия;
д) фосфатная кислота; е) нитрат калия;
ж) бромидная (бромоводородная) кислота.
Домашнее задание:
Напишите формулы и укажите, к какому классу относятся:
1) Гидроксид алюминия; 2) сульфид кадмия; 3) йодидная кислота;
4) хлорид дигидроксохрома (III); 5) оксид марганца (VII).
II. Напишите реакции получения солей:
1) 1NaOH + 1 CO2 à
2) 1H2S + 1 KOH à
3) BaO + CO2 à
4) 1Bi(OH)3 + 1 HNO3 à
5) Zn(OH)2 + NaOH à
6) Fe(OH)2 + H2SO4 à
Назовите полученные соли. Какие это соли?
Шестое занятие
Тема: Строение атома.
Структура атома; строение атома; ядро атома; вокруг находятся; элементарная частица, наименьшая частица; положительная частица; отрицательная…Характеристика частиц атома
а.е.з. – атомная единица заряда. Атомы химических элементов с одинаковым количеством протонов в ядре, но с разным количеством нейтронов и поэтому с…Масса атома 11Н 1 2D 1 3T
водород дейтерий тритий Задание 1. Сколько протонов, нейтронов и электронов в атоме изотопа… Модель ответа: Изотоп кислорода-18 имеет атомную массу А=18 а.е.м. Порядковый номер кислорода в таблице Менделеева 8,…Электронные и электронно-графические формулы атомов
Элементов.
Распределение электронов в атоме начинается с заполнения первого электронного слоя. Распределение электронов записывается в виде электронной… Например: , 3Li 1s22s1 ,- электронные формулы. Количество электронных слоев в атоме соответствует номеру периода, в котором находится элемент.Электронно-графические формулы показывают распределение электронов по атомным орбиталям. Атомная орбиталь– это пространство, которое занимает электронное облако. Атомную орбиталь условно обозначаем | | , а электроны | | . s-орбиталь одна, max. количество s-электронов – 2; р-орбиталей три, max. количество p-электронов 6; d-орбиталей пять, max. количество d-электронов 10; f-орбиталей семь; max. количество f-электронов 14. Электроны занимают орбитали сначала по одному, а потом второй электрон. Однуорбиталь могут занимать max. два электрона.
| Например: 7N | ¯ | ¯ | | | |
1s 2s 2p
Задание 3.Напишите электронную и электронно-графическую формулу атома элемента серы.
Модель ответа: Сера стоит в 3 периоде, в VI-а группе, ее порядковый номер 16. Следовательно, в атоме серы 16 электронов образуют 3 электронных слоя. Электронную формулу запишем так:
16 S 1s2 2s2 2p6 3s2 3p4
На последнем третьем слое в атоме серы 6 электронов, что совпадает с номером группы, в которой стоит этот элемент.
Электронно-графическая формула:
| 16S | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | | |
1s 2s 2p 3s 3p
Задание 4. Напишите электронные и электронно-графические формулы атомов элементов № 8, № 12, № 15.
Домашнее задание:
Напишите электронные и электронно-графические  формулы атомов элементов № 5, 10, 11, 14, 17 и укажите, сколько протонов, нейтронов и электронов в атомах этих элементов.
формулы атомов элементов № 5, 10, 11, 14, 17 и укажите, сколько протонов, нейтронов и электронов в атомах этих элементов.
Седьмое занятие
Тема: Электронный тип элементов.
Электронная формула атома элемента; электронная формула в общем виде; электронный тип элемента. Прочитайте текст и выполните задания 1 и 2:IIIв IVв Vв VIв VIIв
(n-1)d1ns2 (n-1)d2ns2 (n-1)d3ns2 (n-1)d4ns2 (n-1)d5ns2
VIIIв Iв IIв
Например, элемент марганец стоит в VII-в группе четвертого периода. Его…Восьмое занятие
Тема: Химическая связь.
Химическая связь; образовать химическую связь; полярная связь; неполярная связь; смещение электронов; валентные электроны, катион; анион.Девятое занятие
Тема: Типы химических реакций.
Реакция; химическая реакция; процесс; образование связи; разрыв связи; степень окисления элемента; заряд иона; осадок; твердое вещество; газ;… Прочитайте текст и выполните задания 1 и 2: Текст:А) ; б) ; в) ; г) .
Задание 2.Допишите уравнения реакции обмена:
а) 
б) 
в) 
Домашнее задание:
1) Рассчитайте степени окисления элементов в соединениях:
а)  б)
б) 
в) 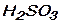 г)
г) 
д) 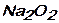 е)
е) 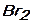
2) Допишите уравнения реакций обмена:
a)1KOH + 1H3PO4à б) FeCl3 + NH3·H2Oà
в) CuSO4 + NaOH à г) Cd(NO3)2 + K2S à
д) Ni(OH)2 + HCl à е) Na2CO3 + HCl à
Десятое занятие
Тема: Уравнения окислительно-восстановительных реакций.
Коэффициент; индекс; степень окисления; процесс окисления; процесс восстановления; вещество-окислитель; вещество-восстановитель. Прочитайте текст и выполните задания 1 и 2:Divide;Hg + 2e- à Hg
1 ÷ 2O - 4e-à O2 +2 -2 Hg – окислитель , O – восстановитель.4) .
Домашнее задание: Укажите, какие реакции окислительно-восстановительные, а какие – нет. К окислительно-восстановительным реакциям составьте электронный баланс.
1)  ;
;
2)  ;
;
3) 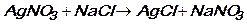 ;
;
4) .
.
Cu + HNO3 à Cu(NO3)2 + NO + H2O.
Al + H2SO4 à Al2(SO4)3 + SO2 + H2O
7) AgNO3 à Ag + NO2 + O2