рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Галогены
Реферат Курсовая Конспект
Галогены
Галогены - раздел Химия, Основные понятия химии Свойства Элементов Vii A Группы. Свойства ...
Свойства элементов VII A группы.
| Свойства | 9F | 17Cl | 35Br | 53I | 85At |
| Атомная масса | 18,998 | 35,453 | 79,909 | 126,904 | [210] |
| Электронная конфигурация* | 
| 
| 
| 
| 
|
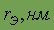
| 0,071 | 0,99 | 0,114 | 0,133 | - |

| 0,133 | 0,181 | 0,196 | 0,220 | 0,230 |
Энергия ионизации

| 17,43 | 13,01 | 11,84 | 10,45 | 9,50 |
| Относительная электроотри- цательность | 4,00 | 3,00 | 2,80 | 2,60 | 2,20 |
| Возможные степени окисления | -1 | -1, +1, +3, +5, +7 | |||
| кларк, ат.% (распространненость в природе) | 0,02 | 0,02 | 3*10-5 | 4*10-6 | следы |
| Агрегатное состояние (н. у.), цвет | газ сетло-зеленый | газ желто-зеленый | жидкость красно-коричневая | тв. вещество черно-фиолетовое | тв. вещество |
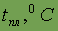
| -223 | -100,98 | -7,2 | 311,5 | |
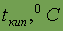
| -187 | -34,5 | 58,75 | 184,5 | |
Плотность 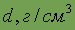
| 1,108 ж. | 1,57 ж. | 3,187 | 4,942 | - |
Стандартный электродный потенциал

| 2,87 | 1,36 | 1,07 | 0,54 | - |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Электронные конфигурации внешнего валентного слоя галогенов относятся к типу ns2np5 (n == 2, 3, 4 и 5 соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов — способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется.
При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Hal2 с ковалентными связями.
Физические свойства галогенов существенно различаются: при нормальных условиях фтор — газ, который трудно сжижается, хлор — также газ, но сжижается легко, бром — жидкость, иод — твердое вещество.
Химические свойства. В отличие от всех других галогенов фтор во всех своих соединениях проявляет только одну степень окисления 1- и не проявляет переменной валентности. Для других галогенов наиболее характерной степенью окисления также является 1-, однако, благодаря наличию свободных d-орбиталей на внешнем уровне они могут проявлять и другие нечетные степени окисления от 1+ до 7+ за счет частичного или полного распаривания валентных электронов.
Наибольшей активностью обладает фтор. Большинство металлов даже при комнатной температуре загорается в его атмосфере, выделяя большое количество теплоты, например:

Без нагревания фтор реагирует и со многими неметаллами (водородом, S, С, Si, P), выделяя при этом также большое количество теплоты:

При нагревании фтор окисляет все другие галогеныпо схеме:

где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны 1+.
Наконец, при облучении фтор реагирует даже с инертными газами:

Взаимодействие фтора со сложными веществами также протекает очень энергично. Он окисляет воду, при этом реакция носит взрывной характер:

Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов, например:
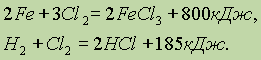
Для этих реакций, как и для всех других, очень важны условия их протекания. Так, при комнатной температуре хлор с водородом не реагирует; при нагревании эта реакция протекает, но оказывается сильно обратимой, а при мощном облучении протекает необратимо (со взрывом) по цепному механизму.
Хлор вступает в реакции со многими сложными веществами, например замещения и присоединения с углеводородами:

Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:

а также обратимо реагирует с водой:

Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала1- (в НС1), у других1+ (в хлорноватистой кислоте НОС1). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами.
Химическая активность бромаменьше, чем фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Являясь более “мягким” реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же как и хлор, растворяется в воде и, частично реагируя с ней, образует так называемую “бромную воду”, тогда как иод практически в воде нерастворим и не способен ее окислять даже при нагревании; по этой причине не существует “йодной воды”.
Получение галогенов. Наиболее распространенным технологическим методом получения фтора и хлора является электролиз расплавов их солей. Бром и иод в промышленности, как правило, получают химическим способом.
В лаборатории хлор получают действием различных окислителей на соляную кислоту, например:

Еще более эффективно окисление проводится перманганатом калия.
Галогеноводороды.Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемаяв их молекулах, — ковалентная полярная, причем полярность связи в ряду HF — НС1 — HBr — HI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить около 400 объемов НСl, 530 объемов HBr и около 400 объемов HI.
При растворении галогеноводородов в воде происходит их диссоциация на ионы и образуются растворы соответствующих галогеноводородных кислот. Причем при растворении HI, HBr и НС1 диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них фтороводородная (плавиковая) кислота является слабой. Это объясняется ассоциацией молекул HF вследствие возникновения между ними водородных связей. Таким образом, сила кислот уменьшается от HI к НF.
Поскольку отрицательные ионы галогеноводородных кислот могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов Н+. Поэтому кислоты HHal реагируют только с металлами, стоящими в ряду напряжений левее водорода.
Все галогениды металлов, за исключением солей Ag и РЬ, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию типа

как качественную для обнаружения соответствующих ионов. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr — желтовато-белого, AgI — ярко-желтого цвета.
В отличие от других галогеноводородных кислот плавиковая кислота взаимодействует с оксидом кремния (IV):

Так как оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее хранят в сосудах из полиэтилена или тефлона.
Кислородсодержащие соединения галогенов. Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Наиболее важными из таких соединений являются кислородсодержащие кислоты галогенов типа НСlOn (n = 1— 4) и соответствующие им соли и ангидриды.
Рассмотрим структурные формулы этих кислот:

Хлорноватистая

Хлористая

Хлорноватая

Хлорная
Для диссоциации по кислотному типу необходим разрыв связи О—Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO — HClO2 — НClO3 — НClO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О—С1 оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О—Н, которая за счет этого ослабляется.
Такая закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома — характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO3, в которой степень окисления азота равна 5+, является более сильной кислотой, чем азотистая кислота HNO2 (степень окисления азота 3+); серная кислота H2SO4 (S6+) — более сильная, чем сернистая кислота Н2SО3 (S4+).
Из солей кислородсодержащих кислот хлора наибольшее значение имеют бертолетова соль (хлорат калия) КсlO3 и хлорная (“белильная”) известь. В лабораторной практике КClO3 широко используется для получения О2 (в присутствии MnO2 в качестве катализатора).
Хлорную известь получают действием хлора на гидроксид кальция (“гашеную известь”):
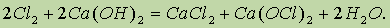
Получаемую смесь называют хлорной известью. Если формально просуммировать состав хлорной извести, то его можно выразить как CaOCl2. Таким образом, хлорная известь представляет собой смешанную соль — хлорид-гипохлорит кальция.
Галогениды. Хлорид натрия (другие названия: каменная соль, поваренная соль, галит) NaCl является приправой к пище, служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др.; используется для консервирования пищевых продуктов. Хлорид калия КСl— ценное калийное удобрение. Хлорид цинка ZnCl2используется для пропитки древесины в целях предохранения от гниения; применяется также при паянии для смачивания поверхности металла (устраняет пленку оксида и припой хорошо пристает к металлу); известны кристаллогидраты ZnCl2 × nН2О. Хлорид бария BaCl2— ядовитое вещество, применяемое для борьбы с вредителями сельского хозяйства (свекловичным долгоносиком, луговым мотыльком и др.). Хлорид кальция CaCl2(безводный) — широко применяется для осушки газов (при этом образуется кристаллогидрат соли СаСl2 × 6Н2O) и в медицине. Хлорид алюминия АlCl3 (безводный) часто используется как катализатор при органических синтезах. Хлорид ртути (II), или сулема, HgCl2 — сильный яд; очень разбавленные растворы соли применяются как сильнодействующее дезинфицирующее средство; используется также для протравливания семян, дубления кожи, в органическом синтезе. Хлорид серебра AgCl— малорастворимая соль, используется в фотографии.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия химии
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ... Основные понятия химии... Все химические вещества состоят из частиц классификация которых в химии и физике достаточно сложна химические...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Галогены
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов