рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Кислород
Реферат Курсовая Конспект
Кислород
Кислород - раздел Химия, Основные понятия химии Свойства 8О. Атомная Масс...
Свойства 8О.
| Атомная масса | 15,99 | кларк, ат.% (распространненость в природе) | |
| Электронная конфигурация* | 
| Агрегатное состояние (н. у.). | газ |
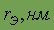
| 0,06 | Цвет | бесцветный |
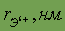
| ¾ | 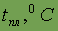
| - 218,8 |
Энергия ионизации
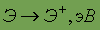
| 13,614 | 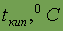
| - 183,0 |
| Относительная электро- отрицательность | 3,5 | Плотность 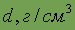
| 1,27тв. |
| Возможные степени окисления | -2,+1,-1,1,+2 | Стандартный электродный потенциал

| ¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Кислород в природе имеет три устойчивых изотопа: 16О, 17О и 18О. В свободном состоянии находится в виде двух аллотропных модификаций — кислород О2 и озон О3.
Как известно, аллотропия — способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле либо строением.
Кислород относят к первой категории аллотропных элементов.
Физические свойства.Кислород в нормальных условиях — газ без цвета и запаха.
Вместе с азотом и незначительным количеством других газов свободный кислород образует атмосферу Земли — воздух (23,15% по массе, или 20,95% по объему).
Получение.В промышленности кислород получают:
1. фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается);
2. электролизом воды.
В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов:

Особенно легко кислород выделяется в результате последней реакции, поскольку в пероксиде водорода H2O2 не двойная, а одинарная связь между атомами кислорода —О—О—.
В частности, пероксиды щелочных металлов используют на космических станциях для обеспечения космонавтов кислородом за счет его регенерации из выдыхаемого СО2:

Химические свойства. Важнейшее химическое свойство кислорода — способность образовывать оксиды почти со всеми элементами Кислород образует соединения со всеми элементами, кроме некоторых благородных газов (гелия, неона, аргона). С большинством металлов кислород реагирует уже при комнатной температуре:

С неметаллами кислород реагирует, как правило, при нагревании. С фосфором кислород активно реагирует
при температуре 60°С:

с серой — при температуре около 250°С:

с углеродом (в виде графита) — при 700—800°С:
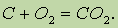
Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:
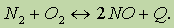
Кислород реагирует и со многими сложными соединениями, например с оксидами азота (II) он реагирует уже при комнатной температуре:

Сероводород, реагируя с кислородом при нагревании, дает серу:

или оксид серы (IV):


в зависимости от соотношения между кислородом и сероводородом.
В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет — такие процессы называются горением.
Кислород не взаимодействует непосредственно с галогенами, золотом и платиной, их оксиды получаются косвенным путем.
Сложные вещества при определенных условиях также взаимодействуют с кислородом. При этом образуются оксиды, а в некоторых случаях — оксиды и простые вещества:

Кислород как окислитель. По величине относительной электроотрицательности кислород является вторым элементом (см. табл.). Поэтому в химических реакциях как с простыми, так и со сложными веществами он является окислителем, так как принимает электроны.
Горение, ржавление, гниение и дыхание протекают при участии кислорода. Это окислительно-восстановительные процессы.
Кислород в химических и металлургических процессов.Процессы окисления протекают интенсивнее в кислороде, чем на воздухе. Это подтверждают простые опыты: горение угля, серы, стальной проволоки в кислороде.
Для ускорения процессов окисления вместо обыкновенноговоздуха применяют кислород или воздух, обогащенный кислородом. Кислород используется для интенсификации окислительных процессов в химической промышленности (производство азотной исернойкислот, искусственного жидкого топлива, смазочных масел и других веществ).
Кислород — эффективное средство интенсификации металлургических процессов. При продувании в доменную печь воздуха, обогащенного кислородом, значительно повышается температура пламени, в результате чего ускоряется процесс плавки и увеличивается производительность печи. Еще больший эффект получается при полной или частичной замене воздуха кислородом в сталеплавильном производстве — мартеновском и бессемеровском процессах: происходит не только интенсификация этих процессов, но и улучшение качества получаемых сталей. Успешно применяется обогащенный кислородом воздух (до 60% О2) в цветной металлургии (окисление сульфидных руд цинка, меди и других металлов).
Применение. Кислород применяется для получения высоких температур. Температура кислородно-ацетиленового пламени достигает 3500 °С, кислородно-водородного — 3000 °С.
В медицине кислород применяется для облегчения дыхания больных (кислородные подушки и палатки). Он используется в кислородных приборах при выполнении работ в трудной для дыхания атмосфере (подземные и подводные работы, высотные и космические полеты и др.)
Озон.Молекула кислорода состоит из двух атомов O2. Химическая связь в ней — ковалентная неполярная, а молекула озона состоит из трех атомов кислорода О3, и хотя кислород и озон образованы одним и тем же элементом, свойства их различны.
Озон — газ с характерным резким, но приятным запахом. Он является еще более сильным окислителем, чем кислород О2. Озон образуется в атмосфере при грозовых разрядах, чем объясняется специфический запах свежести после грозы.
В лабораториях озон получают пропусканием разряда через кислород (реакция эндотермическая):

При взаимодействии озона с раствором иодида калия выделяется иод, тогда как с кислородом эта реакция не идет:

Реакция часто используется как качественная для обнаружения ионов I- или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы Сl- и Вг- .
Озон разрушает органические вещества, окисляет многие металлы, в том числе золото и платину, а также производит белящее и дезинфицирующее действие.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия химии
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ... Основные понятия химии... Все химические вещества состоят из частиц классификация которых в химии и физике достаточно сложна химические...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Кислород
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов