рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Стандартные электродные потенциалы в водных растворах
Реферат Курсовая Конспект
Стандартные электродные потенциалы в водных растворах
Стандартные электродные потенциалы в водных растворах - раздел Химия, Физико-химические характеристики В Таблице Приведены Значения Стандартных Электродных Потенциалов (Е0...
В таблице приведены значения стандартных электродных потенциалов (Е0) при температуре 250С и нормальном атмосферном давлении 101,3 кПа. Все величины выражены по отношению к потенциалу стандартного водородного электрода.
Если условия отличаются от стандартных (250С, 101,3 кПа, концентрации окисленной и восстановленной формы равны 1), то электродный потенциал рассчитывают по уравнению Нернста:

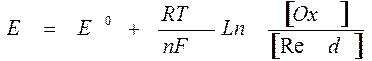 , где:
, где:
Е- электродный потенциал при заданных условиях;
Е0-стандартный электродный потенциал(из справочника);
R-универсальная газовая постоянная(3,14);
Т- заданная температура
[Ox]-концентрация окисленной формы вещества;
[Red]-концентрация восстановленной формы вещества
| Элемент | Электродный процесс | Е0, В | ||
| Азот | 3N2+2e=2N3- 3N2+2H++2e=2HN3 N2+4H2O+2e=2NH2OH+2OH- N2+2H2O+4H++2e=(2NH2OH)H+ N2+4H2O+4e=N2H4+4OH- N2+8H2O+6e=NH4OH+6OH- N2+5H++4e=(N2H4)H+ N2+6H++6e=2NH3 N2+2H2O+6H++6e=2NH4OH N2+8H++6e=2NH4+ | -3,400 -3,100 -3,040 -1,870 -1,160 -0,740 -0,230 +0,057 +0,092 +0,260 | ||
| N3-+7H2O+6e=N2H4+NH3+7OH- HN3+11H++8e=3NH4+ | -0,620 +0,690 | |||
| N2H4+4H2O+2e=2NH4OH+2OH- (N2H4)H++3H++2e=NH4+ | +0,100 +1,270 | |||
| NH2OH+2H2O+2e=NH4OH+2OH- H2N2O2+6H++4e=(2NH2OH)H+ (NH2OH)H++2H++2e=NH4++H2O 2NH3OH+ +H++2e=N2H5+ +2H2O H2N2O2+2H++2e=N2+2H2O | +0,420 +0,500 +1,350 +1,417 +2,650 | |||
| NO2-+H2O+e=NO+2OH- NO2-+2H2O+4e=N2O22-+4OH- NO2-+6H2O+6e=NH4OH+7OH- 2NO2-+3H2O+4e=N2O+6OH- 2NO2-+4H2O+6e=N2+8OH- HNO2+6H++6e=NH3(г) +2H2O 2HNO2+4H++4e=H2N2O2+2H2O HNO2+7H++6e=NH4++2H2O HNO2+H++e=NO+H2O 2HNO2+4H++4e=N2O+3H2O 2HNO2+6H++6e=N2+4H2O 2NO2-+8H++6e=N2(г)+4H2O | -0,460 -0,180 -0,150 +0,150 +0,410 +0,755 +0,830 +0,860 +0,990 +1,290 +1,440 +1,514 | |||
| N2O+10H++8e=2NH4++H2O N2O+H2O+2e=N2+2OH- N2O+2H++2e=N2+H2O | +0,644 +0,940 +1,770 | |||
| 2NO+H2O+2e=N2O+2OH- | +0,760 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Азот | 2NO+2H2O+4e=N2+4OH NO+6H++5e=NH4++H2O 2NO+2H++2e=N2O+H2O 2NO+4H++4e=N2+2H2O | +0,850 +0,834 +1,600 +1,680 | ||
| N2O4(2NO2)+4H2O+8e=N2+8OH- N2O4(2NO2)+2e=2NO2- N2O4+4H++4e=2NO+2H2O NO2(г)+2H++2e=NO+H2O N2O4(2NO2)+2H++2e=2HNO2 NO2 +2H++2e=NO+H2O 2NO2(г) +6H+ +6e=N2O +3H2O N2O4(2NO2)+8H++8e=N2+4H2O | +0,530 +0,880 +1,035 +1,049 +1,070 +1,203 +1,231 +1,350 | |||
| NO3-+H2O+e=NO2+2OH- NO3-+2H2O+2e=N2O4+4OH- NO3-+2H2O+3e=NO+4OH- NO3-+7H2O+8e=NH4OH+9OH- NO3-+H2O+2e=NO2-+2OH- NO3-+8H++6e=(NH2OH)H++2H2O NO3-+2H++e=NO2+H2O 2NO3-+4H++2e=N2O4+2H2O NO3-+2H++2e=NO2-+H2O 2NO3-+17H++14e=(N2H4)H++6H2O NO3-+10H++8e=NH4++3H2O NO3-+3H++2e=HNO2+H2O HNO3+3H++3e=NO+2H2O NO3-+4H++3e=NO+2H2O 2NO3-+10H++8e=N2O+5H2O 2NO3-+12H++10e=N2+6H2O | -0,860 -0,850 -0,140 -0,120 +0,010 +0,730 +0,800 +0,803 +0,838 +0,840 +0,870 +0,940 +0,957 +0,960 +1,116 +1,240 | |||
| Актиний | Ac3++3e=Ac | -2,600 | ||
| Алюминий | A1O2-+2H2O+3e=A1+4OH- H2A1O3-+H2O+3e=A1+4OH- [A1(OH)4]-+3e=A1+4OH- A1(OH)3+3e=A1+3OH- A1F63-+3e=A1+6F- A13++3е=A1 | -2,350 -2,333 -2,336 -2,310 -2,070 -1,660 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Алюминий | A1(OH)3(т)+3H++3e=A1+3H2O A1O2-+4H++3e=A1+2H2O | -1,538 -1,262 | ||
| Барий | Ba2++2e=Ba BaO2(т)+4H++2e=2H2O+Ba2+ | -2,900 +2,369 | ||
| Бериллий | B2O32-+3H2O+4e=2Be+6OH- Be2O32-+3H2O+4e=2Be+6OH- Be(OH)2(т)+2e=Be+2OH- Be2++2e=Be Be(OH)2 +2H++2e=Be +2H2O BeO22-+4H+ +2e=Be +2H2O | -2,630 -2,620 -2,599 -1,850 -1,820 -0,909 | ||
| Бор | H2BO3-+H2O+3e=B+4OH- BF4-+3e=B+4F- H3BO3+3H++3e=B+3H2O BO33-+6H++3e=B +3H2O | -1,790 -1,040 -0,870 -0,165 | ||
| Бром | Br3-+2e=3Br- Br2(г) + 2e =2 Br− Br2 (р-р) + 2e = 2 Br− | +1,050 +1,066 +1,087 | ||
| 2BrO2-+2H2O+2e=Br2+4OH- BrO-+H2O+2e=Br-+2OH- HBrO + H2O + 2e = Br− + 2OH− HBrO +H+ + 2e = Br− + H2O 2HBrO +2H+ + 2e =Br2 (р-р) + 2H2O | +0,450 +0,760 +0,761 +1,340 +1,600 | |||
| 2BrO3− + 6H2O + 10е = Br2 + 12OH− BrO3-+2H2O+4e=BrO-+4OH- BrO3− + 3H2O + 6е = Br− + 6OH− BrO3− +6H+ + 6е =Br− + 3H2O BrO3-+5Н++4е=HBrO+2H2O 2BrO3− +12H+ + 10е =Br2 + 6H2O | +0,500 +0,540 +0,610 +1,440 +1,450 +1,520 | |||
| BrO4-+2H++2e=BrO3-+H2O | +1,763 | |||
| Ванадий | V2++2e=V | -1,175 | ||
| V3++3e=V2+ | -0,255 | |||
| VO2++4H++5e=V+2H2O | -0,250 | |||
| VO2++e=VO+ | -0,044 | |||
| VO+ + 2H+ + е =V3+ + H2O | +0,337 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Ванадий | VO2++4H++3e=V2++2H2O VO2++4H++2e=V3++2H2O V2O5+6H++2e=2VO2++3H2O VO2++2H++1e=VO2++H2O VO2++2H++e=VO2++3H2O VO43-+6H++2e=VO++3H2O H2VO4-+4H++e=VO2++3H2O | +0,360 +0,668 +0,958 +0,999 +1,004 +1,256 +1,314 | ||
| Висмут | Bi+3H++3e=BiH3 | <-0,800 | ||
| Bi2O3+3H2O+6e=2Bi+6OH- BiOC1+2H++3e=Bi+H2O+C1- BiC14-+3e=Bi+4C1- Bi3++3e=Bi | -0,460 +0,160 +0,160 +0,215 | |||
| BiO++2H++3e=Bi+H2O Bi2O3+6H++6e=2Bi+3H2O Bi2O4+H2O+2e=Bi2O3+2OH- Bi2O4+4H++2e=2BiO++2H2O Bi2O5+2H++2e=Bi2O3+H2O NaBiO3+4H++2e=BiO++Na++2H2O BiO3-+6H+ +2e=Bi3++3H2O | +0,320 + 0,371 +0,560 +1,590 +1,607 >+1,800 +1,800 | |||
| Водород | H2+2e=2H | -2,250 | ||
| H++2e=H- 2H2O+2e=H2+2OH- 2H+(10-7M)+2e=H2 2H++2e=H2 HO2-+H2O+2e=3OH- H2O2+2H++2e=2H2O | -1,125 -0,828 -0,414 0,000 +0,880 +1,770 | |||
| Вольфрам | WO2(ТВ) + 4H+ + 4е= W(ТВ) + 2H2O | -0,120 | ||
| W2O5(ТВ) +2H++2е= 2WO2(ТВ) + H2O W(CN)83- + е = W(CN)84 - | -0,031 +0,457 | |||
| WO42-+4H2O+6e=W+8OH- WO3.(ТВ)+6H+ + 6e =W(ТВ) + 3H2O 2WO3.(ТВ)+2H+ + 2e = W2O5 (ТВ)+H2O WO42-+8H++6e=W+4H2O 2WO42- + 6H+ + 2e= W2O5(ТВ) + 3H2O | -1,050 -0,090 -0,029 +0,049 +0,801 | |||
| Гадолиний | Gd3++3e=Gd | -2,397 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Галлий | H2GaO3-+H2O+3e=Ga+4OH- Ga3++3e=Ga Ga(OH)3+3H++3e=Ga+3H2O GaO33-+6H++3e=Ga+3H2O | -1,220 -0,530 -0,419 +0,319 | ||
| Гафний | HfO(OH)2+H2O+4e=Hf+4OH- Hf+4+4e=Hf HfO2++2H++4e=Hf+H2O HfO2+4H++4e=Hf+2H2O | -2,500 -1,700 -1,700 -1,570 | ||
| Германий | Ge+4H++4e=GeH4 | <-0,300 | ||
| GeO+2H++2e=Ge+H2O Ge2++2e=Ge | -0,200 0,000 | |||
| HGeO3-+2H2O+4e=Ge+5OH- GeO2+4H++4e=Ge+2H2O H2GeO3+4H++4e=Ge+3H2O H2GeO3+4H++2e=Ge2++3H2O GeO2+2H++2e=GeO(коричневый)+H2O | -1,000 -0,150 -0,130 -0,363 -0,120 | |||
| Гольмий | Ho3++3e=Ho | -2,319 | ||
| Диспрозий | Dy3++3e=Dy | -2,353 | ||
| Железо | FeS+2e=Fe+S2- Fe(OH)2+2e=Fe+2OH- FeCO3+2e=Fe+CO32- Fe2++2e=Fe Fe(OH)2+2H++2e=Fe+2H2O | -0,950 -0,877 -0,756 -0,440 -0,047 | ||
| FeOOH(т)+H2O+e=Fe(OH)2+OH- Fe(OH)3+e=Fe(OH)2+OH- Fe3++H2O+e=FeO(т)+2H+ Fe2O3+H2O+2H++2e=2Fe(OH)2 Fe2O3+6H++6e=2Fe+3H2O Fe3++3e=Fe Fe(OH)3+3H++3e=Fe+3H2O Fe2O3+4H++2e=FeOH++H2O Fe(OH)3+H++e=Fe(OH)2+H2O Fe(CN)63-+3e=Fe(CN)64- Fe3++e=Fe2+ Fe(C12H8N2)33++e= Fe(C12H8N2)32+ | -0,666 -0,560 -0,103 -0,057 -0,051 -0,037 +0,160 +0,059 +0,271 +0,356 +0,770 +1,060 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Железо | Fe3O4+8H++8e=3Fe+4H2O Fe3O4+8H++2e=3Fe3++4H2O FeO42-+8H++3e=Fe3++4H2O HFeO4-+7H++3e=Fe3++4H2O HFeO4-+4H++3e=FeOOH+2H2O 2HFeO4-+8H++6e=Fe2O3+5H2O | -0,085 +0,980 +1,700 +2,070 +2,080 +2,090 | ||
| Золото | Au(CN)2-+e=Au+2CN- Au(CNS)2-+e=Au+2CNS- AuBr2-+e=Au+2Br- AuC12-+e=Au+2C1- Au++e=Au | -0,610 +0,690 +0,960 +1,110 +1,680 | ||
| Au(CNS)4-+2e=Au(CNS)2-+2CNS- AuBr4-+2e=AuBr2-+2Br- AuC14-+2e=AuC12-+2C1- Au(CNS)4-+3e=Au+4CNS- H2AuO3-+H2O+3e=Au+4OH- AuBr4-+3e=Au+4Br- AuC14-+3e=Au+4C1- Au3++2e=Au+ Au2O3+6H++6e=2Au+3H2O Au3++3e=Au H3AuO3+3H++3e=Au+3H2O | +0,640 +0,820 +0,930 +0,660 +0,700 +0,870 +0,990 +1,410 +1,457 +1,500 +1,565 | |||
| Йод | I2↓+2e=2I- I2+2e=2I- | +0,536 +0,621 | ||
| I3-+2e=3I- | +0,545 | |||
| ICN+2e=I-+CN- 2IO-+H2O+2e=I2+4OH- HIO+H++2e=I-+H2O 2ICN+2H++2e=I2+2HCN 2IBr2-+2e=I2 +4Br- IO-+H2O+2e=I-+2OH- HIO+H++2e=I-+H2O 2IBr+2e=I2+2Br- 2IC12-+2e=J2+4C1- 2IC1+2e=I2+2C1- | +0,300 +0,450 +0,490 +0,630 +0,870 +0,890 +0,990 +1,020 +1,060 +1,190 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Йод | 2HIO+2H++2e=I2+2H2O IO3-+2H2O+4e=IO-+4OH- 2IO3-+6H2O+10e=I2+12OH- JO3-+3H2O+6e=I-+6OH- IO3-+6H++6e=I-+3H2O 2IC13+6e=I2+6C1- IO3-+5H++4e=HIO+2H2O 2IO3-+12H++10e=I2+6H2O | +1,450 +0,140 +0,210 +0,260 +1,080 +1,280 +1,140 +1,190 | ||
| H3IO62-+3H2O+8e=I-+9OH- H3IO62-+2e=JO3-+3OH- | +0,370 +0,700 | |||
| H5IO6+7H++8e=I-+6H2O H5IO6+H++2e=IO3-+3H2O | +1,240 +1,600 | |||
| Индий | In(OH)3+3e=In+3OH- In3++2e=In+ In3++3e=In | -1,000 -0,400 -0,330 | ||
| Иридий | Ir2O3+3H2O+6e=2Ir+6OH- IrC163-+3e=Ir+6C1- Ir+3+3e=Ir | +0,100 +0,770 +1,150 | ||
| IrO2+2H2O+4e=Ir+4OH- IrC162-+4e=Ir+6C1- IrO2+4H++4e=Ir+H2O IrC162-+e=IrC163- | +0,100 +0,830 +0,930 +1,020 | |||
| Иттербий | Yb3++e=Yb2+ | -1,205 | ||
| Иттрий | Y3++3e=Y | -2,372 | ||
| Кадмий | CdS+2e=Cd+S2- Cd(CN)42-+2e=Cd+4CN- Cd(OH)2+2e=Cd+2OH- CdO+H2O+2e=Cd+2OH- CdCO3+2e=Cd+CO32- Cd(OH)2+2e=Cd+2OH- Cd(NH3)42++2e=Cd+4NH3 Cd2++2e=Cd CdSO4+2e=Cd+SO42- Cd(OH)2+2H++2e=Cd+2H2O CdO+2H++2e=Cd+H2O | -1,175 -1,090 -0,810 -0,783 -0,740 -0,658 -0,610 -0,403 -0,246 +0,005 +0,063 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Калий | K++e=K | -2,925 | ||
| Кальций | Ca(OH)2+2e=Ca+2OH- Ca2++2e=Ca | -3,030 -2,866 | ||
| Кислород | O2+H2O+2e=HO2-+OH- O2+2H2O+2e=H2O2+2OH- O2+2H2O+4e=4OH- O2+2H++2e=H2O2 O2+4H+(10-7M)+4e=2H2O O2+4H++4e=2H2O | -0,076 -0,146 +0,401 +0,682 +0,815 +1,229 | ||
| O3+H2O+2e=O2+2OH- O3+6H++6e=3H2O O3+2H++2e=O2+H2O | +1,240 +1,511 +2,070 | |||
| HO2-+H2O+2e=3OH- H2O2+2H+=2H2O | +0,880 +1,770 | |||
| Кобальт | СоS(β)+2e=Co+S2- CoS(α)+2e=Co+S2- Co(OH)2+2e=Co+2OH- CoCO3+2e=Co+CO32- Co(NH3)62++2e=Co+6NH3 Co2++2e=Co Co(OH)2+2H++2e=Co+2H2O CoO+2H++2e=Co +H2O | -1,070 -0,900 -0,730 -0,640 -0,420 -0,277 +0,095 +0,170 | ||
| Co(NH3)63++e=Co(NH3)62+ Co(OH)3+e=Co(OH)2+OH- CoOOH(т)+H2O+e=Co(OH)2+OH0 Co3++e=Co Co3++e=Co2+ | +0,100 +0,170 +0,189 +0,330 +1,808 | |||
| Кремний | Si+4H2O+4e=SiH4+4OH- Si++4H++4e=SiH4 | -0,730 +0,100 | ||
| SiO32-+3H2O+4e=Si+6OH- | -1,700 | |||
| SiF62-+4e=Si+6F- SiO2(кварц)+4H++4e=Si+2H2O H2SiO3(тв) +4H++4e=Si+3H2O H2SiO3(водн)+4H++4e=Si+3H2O SiO32-+6H++4e=Si+3H2O | -1,200 -0,857 -0,807 -0,789 -0,455 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Лантан | La(OH)3+3e=La+3OH- La3++3e=La | -2,900 -2,520 | ||
| Литий | Li++e=Li | -3,030 | ||
| Магний | Mg(OH)2+2e=Mg+2OH- Mg2++2e=Mg Mg(OH)2+2H++2e=Mg+2H2O | -2,690 -2,363 -1,862 | ||
| Марганец | MnCO3+2e=Mn+CO32- Mn2++2e=Mn Mn(OH)2+2e=Mn+2OH- Mn(OH)2+2H++2e=Mn+2H2O | -1,480 -1,190 -1,180 -0,727 | ||
| Mn(CN)63-+e=[Mn(CN)6]4- Mn(OH)3+e=Mn(OH)2+OH- Mn2O3+6H++2e=2Mn2++3H2O Mn3++e=Mn2+ | -0,244 +0,100 +1,443 +1,510 | |||
| MnO2(т)+2H2O+2e=Mn(OH)2(т)+2OH- MnO2+4H++2e=Mn2++2H2O | -0,043 +1,230 | |||
| MnO42-+2H2O+2e=MnO2+4OH- MnO42-+4H++2e=MnO2+2H2O MnO4-+e=MnO42- MnO4-+2H2O+3e=MnO2+4OH- MnO4-+8H++5e=Mn2++4H2O MnO4-+4H++3e=MnO2+2H2O | +0,600 +2,260 +0,560 +0,600 +1,510 +1,690 | |||
| Медь | Cu2S+2e=2Cu+S2- Cu(CN)2-+e=Cu+2CN- Cu2O+H2O+2e=2Cu+2OH- CuCNS+e=Cu+CNS- CuI+e=Cu+I- Cu(NH3)2++e=Cu+2NH3 CuI22-+e=Cu+2I- CuBr+e=Cu+Br- CuC1+e=Cu +C1- Cu++e=Cu | -0,890 -0,430 -0,360 -0,270 -0,185 -0,120 0,000 +0,030 +0,137 +0,520 | ||
| CuS+2e=Cu+S2- Cu(OH)2+2e=Cu+2OH- 2Cu(OH)2+2e=Cu2O+2OH-+H2O | -0,710 -0,220 -0,080 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Медь | Cu(NH3)42++2e=Cu+4NH3 Cu(NH3)42++e=Cu(NH3)2++2NH3 Cu2++e=Cu+ 2Cu2++H2O+2e=Cu2O+2H+ Cu2++2e=Cu Cu2++C1-+e=CuC1 CuO+2H++2e=Cu+H2O Cu(OH)2+2H++2e=Cu+2H2O Cu2++Br-+e=CuBr 2CuO+2H++2e=Cu2O+H2O Cu2++I-+e=CuI Cu2++2CN-+e=[Cu(CN)2]- Cu2O3+6H++2e=2Cu2++3H2O Cu3++e=Cu2+ | -0,070 -0,010 +0,153 +0,203 +0,340 +0,538 +0,507 +0,609 +0,640 +0,669 +0,860 +1,103 +2,000 +2,400 | ||
| Молибден | Mo+3+3e=Mo | -0,200 | ||
| MoO2+4H++4e=Mo+2H2O | -0,072 | |||
| MoO2++4H++2e=Mo3++2H2O Mo(CN)83-+e=Mo(CN)84- | ~0,000 +0,730 | |||
| H2MoO4+2H++2e=MoO2+2H2O MoO42-+4H2O+6e=Mo+8OH- H2MoO4+6H++6e=Mo+4H2O MoO42-+8H++6e=Mo+4H2O MoO3+2H++2e=MoO2+H2O MoO22++e=MoO2+ MoO42-+4H++2e=MoO2+2H2O | -1,091 -1,050 0,000 +0,154 +0,320 +0,480 +0,606 | |||
| Мышьяк | As↓+3H2O+3e=AsH3↑+3OH- As↓+3H++3e=AsH3↑ | -1,370 -0,600 | ||
| AsO2-+3H2O+3e=As↓+4OH- As2O3+6H++6e=2As+3H2O HAsO2+3H++3e=As↓+2H2O | -0,680 +0,234 +0,247 | |||
| AsO43-+2H2O+2e=AsO2-+4OH- AsO43-+2H2O+2e=AsO2-+4OH- H3AsO4+5H++5e=As+4H2O H3AsO4+2H++2e=HAsO2+2H2O | -0,710 -0,670 +0,370 +0,560 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Мышьяк | AsO43-+8H++5e=As+4H2O | +0,648 | ||
| Натрий | Na++e=Na Na2O2+2H2O+2e=2Na++4OH- | -2,714 +1,204 | ||
| Неодим | Nd3++3e=Nd | -2,431 | ||
| Нептуний | Np3++3e=Np | -1,856 | ||
| Np4++e=Np3+ | +0,152 | |||
| NpO2++4H++2e=Np3++2H2O | +0,451 | |||
| Никель | NiSγ+2e=Ni+S2- NiSα+2e=Ni+S2- Ni(OH)2+2e=Ni+2OH- Ni(NH3)62++2e=Ni+6NH3 NiCO3+2e=Ni+CO32- Ni(CN)42-+2e=Ni+4CN- Ni2++2e=Ni Ni(OH)2+2H++2e=Ni+2H2O NiO+2H++2e=Ni+H2O | -0,990 -0,760 -0,720 -0,490 -0,450 -0,400 -0,230 +0,110 +0,116 | ||
| NiOOH+H2O+e=Ni(OH)2+OH- | +0,784 | |||
| NiO2+2H2O+2e=Ni(OH)2+2OH- NiO2+4H++2e=Ni2++2H2O NiO42-+8H++4e=Ni+4H2O | +0,490 +1,680 >+1,800 | |||
| Ниобий | NbO+2H++2e=Nb+H2O Nb3++3e=Nb | -0,733 -1,100 | ||
| NbO2+2H++2e=NbO+H2O | -0,625 | |||
| Nb2O5+10H++10e=Nb+5H2O NbO(SO4)2-+2H++5e=Nb+H2O+2SO42- NbO3++2H++2e=Nb3++H2O Nb2O5+2H++2e=2NbO2+H2O NbO(SO4)2-+2H++2e=Nb3++H2O+2SO42- | -0,650 -0,630 -0,340 -0,289 -0,100 | |||
| Олово | Sn+4H++4e=SnH4 | -1,074 | ||
| SnS+2e=Sn+S2- HSnO2-+H2O+2e=Sn+3OH- [Sn(OH)3]-+2e=Sn +3OH- [SnC13]-+2e=Sn(т)+3C1- Sn2++2e=Sn | -0,940 -0,910 -0,790 -0,201 -0,136 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Олово | SnO+2H++2e=Sn+H2O Sn(OH)2+2H++2e=Sn+H2O | -0,104 -0,091 | ||
| [Sn(OH)6]2-+2e=[Sn(OH)3]-+3OH- SnO2+2H2O+4e=Sn+4H2O Sn(OH)62-+2e=HSnO2-+3OH-+H2O SnF62-+4e=Sn+6F- SnO2+3H++2e=SnOH++H2O SnO2+2H++2e=SnO+H2O SnO2+4H++4e=Sn+2H2O SnO2+4H++2e=Sn2++2H2O Sn(OH)4+4H++4e=Sn+4H2O Sn(OH)4+4H++4e=Sn+4H2O Sn4++4e=Sn [SnC16]2-+2e=[SnC13]-+3C1- [SnC16]2-+2e=SnC142-+2C1- Sn(OH)3++3H++3H++2e=Sn+3H2O Sn4++2e=Sn2+ | -0,960 -,945 -0,930 -0,250 -0,194 -0,108 -0,106 -0,094 -0,080 -0,008 +0,010 +0,139 +0,141 +0,142 +0,151 | |||
| Осмий | Os2++2e=Os | +0,850 | ||
| OsC162-+e=OsC163- | +0,850 | |||
| OsC163-+e=Os2++6C1- OsC163-+3e=Os+6C1- | +0,710 +0,400 | |||
| HOsO5-+4H2O+8e=Os+9OH- OsO4+8H++8e=Os+4H2O OsO4+6C1-+8H++4e=OsC162-+4H2O | +0,020 +0,850 +1,000 | |||
| Палладий | Pd(OH)2+2e=Pd+2OH- PdC142-+2e=Pd+4C1- PdO+2H++2e=Pd+H2O Pd2++2e=Pd PdI62-+2e=PdI42-+2I- | +0,070 +0,623 +0,896 +0,987 +0,623 | ||
| Pd(OH)4+2e=Pd(OH)2+2OH- PdC162-+4e=Pd+6C1- PdBr62-+2e=PdBr42-+2Br- PdO2+2H++2e=PdO+H2O PdC162-+2e=PdC142-+2C1- | +0,730 +0,960 +0,993 +1,283 +1,290 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Платина | PtS+2e=Pt+S2- Pt(OH)2+2e=Pt+2OH- PtBr42-+2e=Pt+4Br- PtC142-+2e=Pt+4C1- Pt(OH)2+2H++2e=Pt+H2O | -0,950 +0,150 +0,580 +0,730 +0,980 | ||
| Pt2++2e=Pt | +1,188 | |||
| PtS2+2e=PtS+S2- PtI62-+2e=PtI42-+2I- PtBr62-+2e=PtBr42-+2Br- PtC162-+2e=PtC142-+2C1- PtO2+2H++2e=Pt(OH)2 | -0,640 +0,393 +0,590 +0,720 +1,045 | |||
| Плутоний | Pu(OH)3+3e=Pu+3OH- Pu3++3e=Pu Pu2O3+6H++6e=2Pu+3H2O | -2,420 -2,031 -1,592 | ||
| Pu(OH)4+e=Pu(OH)3+OH- 2PuO2+2H++2e=Pu2O3+H2O Pu4++e=Pu3+ Pu(OH)4+4H++e=Pu3++4H2O PuO22++e=PuO2+ PuO22++4H++3e=Pu3++2H2O PuO22++4H++2e=Pu4++2H2O | -0,950 -0,455 +0,967 +1,182 +0,916 +1,017 +1,040 | |||
| PuO22++2e=PuO2 PuO3+H2O+2H++2e=Pu(OH)4 PuO3+2H++2e=PuO2+H2O | +1,092 +1,325 +1,485 | |||
| Празеодим | Pr3++3e=Pr | -2,462 | ||
| Прометий | Pm3++3e=Pm | -2,423 | ||
| Радий | Ra2++2e=Ra | -2,920 | ||
| Рений | Re+e=Re- | -0,400 | ||
| Re++2e=Re- | -0,230 | |||
| Re3++3e=Re | +0,300 | |||
| ReO2+4H++e=Re3++2H2O ReO2+4H++4e=Re+2H2O | +0,157 +0,260 | |||
| ReO3+2H++2e=ReO2+H2O ReO42-+8H++3e=Re3++4H2O | +0,400 +0,795 | |||
| ReO4-+2H2O+3e=ReO2+4OH- | -0,595 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Рений | ReO4-+4H2O+7e=Re+8OH- ReO4-+8H++7e=Re+4H2O ReO4-+8H++4e=Re3++4H2O ReO4-+4H++3e=ReO2+2H2O ReO4-+2H++e=ReO3+H2O | -0,584 +0,370 +0,422 +0,510 +0,770 | ||
| Родий | RhC163-+3e=Rh+6C1- Rh3++3e=Rh Rh2O3+6H++6e=2Rh+3H2O | +0,440 +0,800 +0,870 | ||
| RhO2+4H++6C1-+e=RhC163-+2H2O RhO2++2H++e=Rh3++H2O | +1,400 +1,400 | |||
| RhO42-+6H++2e=RhO2++3H2O | +1,460 | |||
| Ртуть | Hg2I2+2e=2Hg+2I- Hg2O+H2O+2e=2Hg+2OH- Hg2Br2+2e=2Hg+2Br- Hg2C12+2e=2Hg+2C1- | -0,041 +0,098 +0,140 +0,268 | ||
| HgS(красный)+2e=Hg+S2- HgS(черный)+2e=Hg+S2- Hg(CN)42-+2e=Hg+4CN- HgI42-+2e=Hg+4I- HgO(красная)+H2O+2e=Hg+2OH- HgBr42-+2e=Hg+4Br- HgC14-+2e=Hg+4C1- Hg2++2e=Hg 2Hg2++2e=Hg22+ HgO+2H++2e=Hg+H2O Hg(OH)2=2H+=2e=Hg+2H2O | -0,700 -0,690 -0,370 -0,040 +0,098 +0,210 +0,480 +0,850 +0,920 +0,926 +1,034 | |||
| Рубидий | Rb++e=Rb | -2,925 | ||
| Рутений | Ru2++2e=Ru | +0,450 | ||
| RuC13+3e=Ru+3C1- | +0,680 | |||
| RuC15-+2e=Ru2++5C1- | +0,300 | |||
| RuO2+4H++4e=Ru+2H2O RuC15OH2-+H++e=RuC152-+H2O | +0,790 +1,300 | |||
| RuO4-+e=RuO42- | +0,600 | |||
| RuO4+e=RuO4- | +1,000 | |||
| Самарий | Sm3++3e=Sm | -3,121 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Свинец | PbS+2e=Pb+S2- PbO+H2O+2e=Pb+2OH- | -0,930 -0,580 | ||
| HPbO2-+H2O+2e=Pb+3OH- PbCO3+2e=Pb+CO32- PbHPO4+2e=Pb+HPO42- PbI2+2e=Pb+2I- PbSO4+2e=Pb+SO42- PbF2+2e=Pb+2F- PbBr2+2e=Pb+2Br- PbC12+2e=Pb+2C1- Pb2++2e=Pb PbO+2H++2e=Pb+H2O Pb(OH)2+2H++2e=Pb+Н2O PbSO4(т)+8H++8e=PbS(т)+4H2O PbO32-+H2O+2e=PbO22-+2OH- PbO2+2H2O+2e=[Pb(OH)4]2- PbO2+H2O+2e=PbO+2OH- Pb4++4e=Pb Pb3O4+2H++2e=3PbO+H2O 3PbO2+4H++2e=Pb3O4+2H2O PbO2+4H++2e=Pb2++2H2O PbO2+SO42-+4H++2e=PbSO4+2H2O Pb4++2e=Pb2+ PbO32-+4H++3e=PbO(кр)+2H2O 3PbO32-+10H++4e=Pb3O4+5H2O | -0,540 -0,506 -0,465 -0,365 -0,356 -0,350 -0,280 -0,268 -0,126 +0,248 +0,277 +0,304 +0,200 0,201 +0,280 +0,840 +0,972 +1,127 +1,449 +1,685 +1,694 +2,001 +2,515 | |||
| Селен | Se+2e=Se2- Se+2H++2e=H2Se | -0,920 -0,400 | ||
| SeO32-+3H2O+4e=Se+6OH- H2SeO3+4H++4e=Se+3H2O | -0,366 +0,741 | |||
| SeO42-+H2O+2e=SeO32-+2OH- SeO42-+4H++2e=H2SeO3+H2O | +0,050 +1,150 | |||
| Сера | S22-+2e=2S2- S+2e=S2- S+H2O+2e=HS-+OH- 2S+2e=S22- 5S+2e=S52- | -0,524 -0,480 -0,478 -0,476 -0,340 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Сера | S +H++2e=HS- S +2H++2e=H2S | -0,065 +0,170 | ||
| S22-+2e=2S2- S4O62-+2e=2S2O32- | -0,524 +0,090 | |||
| 2SO32-+2H2O+2e=S2O42-+4OH- SO32-+3H2O+4e=S+6OH- 2SO32-+3H2O+4e=S2O32-+6OH- 2H2SO3+H++2e=HS2O4-+2H2O SO32-+6H++6e=S2-+3H2O 2H2SO3+2H++4e=S2O32-+3H2O SO2(г)+4H++4e=S(т)+2H2O H2SO3+4H++4e=S+3H2O 2SO32-+6H++4e=S2O32-+3H2O | -1,120 -0,900 -0,580 -0,080 +0,231 +0,400 +0,451 +0,449 +0,705 | |||
| SO42-+H2O+2e=SO32-+2OH- 2SO42-+5H2O+8e=S2O32-+10OH- SO42-+4H2O+2e=SO32-+2OH- SO42-+4H2O+6e=S+8OH- 2SO42-+4H++2e=S2O62-+2H2O S2O32-+6H++8e=2S2-+3H2O S4O62-+2e=2S2O32- SO42-+8H++8e=S2-+4H2O SO42-+4H++2e=H2SO3+H2O SO42-+2H++2e=SO32-+H2O 2SO42-+10H++8e=S2O32-+5H2O SO42-+10H++8e=H2S+4H2O SO42-+8H++6e=S+4H2O S2O32-+6H++4e=2S+3H2O S2O62-+4H++2e=2H2SO3 S2O82-+2e=2SO42- S2O82-+2H++2e=HSO4- | -0,930 -0,760 -0,750 -0,750 -0,220 -0,006 +0,080 +0,149 +0,170 +0,200 +0,290 +0,311 +0,357 +0,500 +0,564 +2,010 +2,123 | |||
| Серебро | Ag2S+2e=2Ag+S2- Ag(CN)32-+e=Ag+3CN- Ag(CN)2-+e=Ag+2CN- AgI+e=Ag+I- AgCN+e=Ag+CN- | -0,710 -0,510 -0,290 -0,152 -0,040 | ||
| Элемент | Электродный процесс | Е0, В | ||
| Серебро | Ag2S+2H++2e=2Ag+H2S Ag(S2O3)23-+e=Ag+2S2O32- AgBr+e=Ag +Br- AgCH3COO+e=Ag+CH3COO- AgCNS+e=Ag+CNS- Ag4[Fe(CN)6]+4e=Ag+[Fe(CN)6]4- AgC1+e=Ag+C1- AgN3+e=Ag +N3- Ag2O+H2O+2e=2Ag+2OH- AgJO3+e=Ag+IO3- Ag2SeO3+2e=2Ag+SeO32- Ag(NH3)2++e=Ag+2NH3 AgOCN+e=Ag+OCN- Ag(SO3)22-+e=Ag+2SO32- Ag2CrO4+2e=2Ag+CrO42- Ag2CO3+2e=2Ag+CO32- Ag2C2O4+2e=2Ag+C2O42- Ag2MoO4+2e=2Ag+MoO42- Ag2WO4+2e=2Ag+WO42- AgBrO3+e=Ag+BrO3- AgNO2+e=Ag+NO2- Ag2SO4+2e=2Ag+SO42- AgC2H3O2↓+e=Ag+C2H3O2- AgF+e=Ag+F- Ag++e=Ag Ag2O+2H++2e=2Ag+H2O Ag2O2+4H++4e=2Ag+2H2O | -0,037 +0,010 +0,071 +0,071 +0,090 +0,148 +0,224 +0,293 +0,344 +0,350 +0,363 +0,373 +0,410 +0,430 +0,447 +0,460 +0,472 +0,490 +0,530 +0,550 +0,590 +0,635 +0,640 +0,779 +0,799 +1,173 +1,802 | ||
| 2AgO+H2O+2e=Ag2O+2OH- 2AgO+2H++2e=Ag2O+H2O Ag2++e=Ag+ | +0,600 +1,398 2,000 | |||
| Ag2O3+H2O+2e=2AgO+2OH- AgO++2H++e=Ag2++H2O Ag3++2e=Ag2+ Ag3++2e=Ag2+ | +0,740 +2,100 +1,800 +1,900 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Скандий | Sc3++3e=Sc Sc(OH)3+3H++3e=Sc+3H2O | -2,077 -1,784 | ||
| Стронций | Sr2++2e=Sr | -2,888 | ||
| Сурьма | Sb+3H++3e=SbH3 | -0,510 | ||
| SbO2-+2H2O+3e=Sb+4OH- Sb2O3+6H++6e=2Sb+3H2O SbO++2H++3e=Sb+H2O SbO2-+4H++3e=Sb+2H2O | -0,675 +0,152 +0,212 +0,446 | |||
| SbS42-+2e=SbS2-+2S2- SbO3-+H2O+2e=SbO2-+2OH- SbO3-+2H++2e=SbO2-+H2O Sb2O5+6H++4e=2SbO++3H2O Sb2O5+4H++4e=Sb2O3+2H2O Sb2O4+4H++2e=2SbO++2H2O | -0,600 -0,430 +0,353 +0,580 +0,671 +0,680 | |||
| Таллий | Tl2S+2e=2Tl+S2- TlI+e=Tl+I- TlBr+e=Tl+Br- TlC1+e=Tl+C1- Tl2SO4+2e=2Ti+SO42- TlOH+e=Tl+OH- Tl++e=Tl TlOH+H++e=Tl+H2O | -0,930 -0,753 -0,658 -0,557 -0,436 -0,344 -0,336 +0,778 | ||
| Tl(OH)3+2e=TlOH+2OH- Tl2O3+3H2O+4e=2Tl++6OH- Tl3++3e=Tl Tl3++3e=Tl+ | -0,050 +0,020 +0,741 +1,252 | |||
| Тантал | Ta2O5+10H++10e=2Ta+5H2O | -0,750 | ||
| Теллур | Te+2e=Te2- 2Te+2e=Te22- Te+2H++2e=H2Te | -1,140 -0,840 -0,720 | ||
| TeO32-+3H2O+4e=Te+6OH- TeO2+4H++4e=Te+2H2O TeO2H++3H++4e=Te+2H2O Te+4+4e=Te | -0,570 +0,530 +0,560 +0,568 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Теллур | TeO42-+H2O+2e=TeO32-+2OH- TeO42-+2H++2e=TeO32-+H2O H6TeO6+2H++2e=TeO2+4H2O | +0,400 +0,892 +1,020 | ||
| Тербий | Tb3++3e=Tb | -2,391 | ||
| Технеций | Tc2++2e=Tc | +0,400 | ||
| TcO2+4H++2e=Tc2++H2O TcO2+4H++4e=Tc+2H2O | +0,144 +0,272 | |||
| TcO3+2H++2e=TcO2+H2O | +0,757 | |||
| TcO4-+8H++5e=Tc2++4H2O TcO4-+2H++2e=TcO3+H2O TcO4-+4H++3e=TcO2(т)+2H2O | +0,500 +0,700 +0,770 | |||
| Титан | Ti2++2e=Ti TiO+2H++2e=Ti+H2O | -1,630 -1,306 | ||
| Ti3++e=Ti Ti3++e=Ti2+ | -1,208 -0,368 | |||
| TiF62-+4e=Ti+6F- TiO2++2H++4e=Ti+H2O TiO2+4H++4e=Ti+2H2O TiO2(рутил)+4H++e=Ti3++2H2O TiO2(рутил)+4H++2e=Ti2++2H2O TiO2++2H++2e=Ti2++H2O TiOH3++H++e=Ti3++H2O Ti(OH)22++2H++e=Ti3++2H2O TiO2++2H++e=Ti3++H2O | -1,190 -0,880 -0,860 -0,666 -0,502 -0,135 -0,055 +0,099 +0,100 | |||
| Торий | Th(OH)4+4e=Th+4OH- Th4++4e=Th ThO2+4H++4e=Th+2H2O | -2,480 -1,899 -1,789 | ||
| Тулий | Tm3++3e=Tm | -2,278 | ||
| Углерод | С(графит)+4H++2e=CH4 | -0,132 | ||
| CO+6H++6e=CH4+H2O HCOO-+2H2O+2e=HCHO+3OH- CNO-+H2O+2e=CN-+2OH- CO(г)+2H++4e=C(гр)+H2O | +0,497 -1,070 -0,970 +0,518 | |||
| 2CO2+2H++2e=H2C2O4 H2CO3+2H++2e=H2C2O4 | -0,490 -0,386 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Углерод | CO2+2H++2e=HCOOH CO2+2H++2e=CO+H2O CH3COOH+2H++2e=CH3CHO HCOOH+2H++2e=HCHO+H2O CO2+N2+6H++6e=CO(NH2)2+H2O HCOOH+4H++4e=CH3OH+H2O HCOO-+3H++2e=HCHO+H2O CH3CHO+2H++2e=C2H5OH HCHO+2H++2e=CH3OH CO32-+6H++4e=HCHO+2H2O HCOO-+5H++4e=CH3OH+H2O CO2(г)+4H++4e=C(гр)+2H2O CO32-+8H++6e=CH3OH+2H2O CO32-+3H++2e=HCOO-+H2O 2HCNO+2H++2e=(CN)2+2H2 (CN)2+2H++2e=2HCN 2CO32-+4H++2e=C2O42-+2H2O C2H5OH+2H++2e=C2H6+H2O CO32-+6H++4e=C(графит)+3H2O CH3OH+2H++2e=CH4+H2O C6H4O2(хинон)+2H++2e=C6H4(OH)2(гидрохинон) (CNS)2↑+2e=2CNS- | -0,200 -0,120 -0,120 -0,010 +0,100 +0,145 +0,167 +0,190 +0,190 +0,197 +0,199 +0,207 +0,209 +0,227 +0,330 +0,370 +0,441 +0,460 +0,475 +0,590 +0,699 +0,770 | ||
| Уран | U(OH)3+3e=U+3OH- U3++3e=U U2O3+6H++6e=2U+3H2O | -2,170 -1,798 -1,346 | ||
| UO2+2H2O+4e=U+4OH- UO2+4H++4e=U+2H2O U4++e=U3+ UO2+4H++e=U3++2H2O | -2,390 -1,444 -0,607 -0,382 | |||
| UO2++4H++e=U4++2H2O | +0,550 | |||
| UO22++e=UO2+ UO22++4H++2e=U4++2H2O UO3+H2O+2H++2e=UO2+2H2O UO22++2e=UO2 UO3+2H++2e=UO2+H2O | +0,062 +0,333 +0,368 +0,450 +0,657 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Фосфор | P+3H2O+3e=PH3+3OH- P+3H++3e=PH3 | -0,890 -0,060 | ||
| H2PO2-+e=P+2OH- H3PO2+H++e=P+2H2O | -2,050 -0,510 | |||
| HPO32-+2H2O+3e=P+5OH- HPO32-+2H2O+2e=H2PO2-+3OH- H3PO3+3H++3e=P(белый)+3H2O H3PO3+2H++2e=H3PO2+H2O H3PO3+3H++3e=P(красный)+3H2O | -1,710 -1,570 -0,502 -0,500 -0,454 | |||
| PO43-+2H2O+2e=HPO32-+3OH- 2H3PO4+2H++2e= H4P2O6+2H2O H3PO4+5H++5e=P(белый)+4H2O H3PO4+4H++4e=H3PO2+2H2O H3PO4+5H++5e=P(красный)+4H2O H3PO4+2H++2e=H3PO3+H2O H4P2O6+2H++2e=2H3PO3 | -1,120 -0,940 -0,411 -0,390 -0,383 -0,276 +0,380 | |||
| Фтор | F2O+2H++4e=2F-+H2O | +2,100 | ||
| F2+2H++2e=2HF(вод) F2+2e=2F- | +3,060 +2,870 | |||
| Хлор | C12(г)+2H++2e=2HC1(г) С12+2e=2C1- С12 (вод)+2e=2C1- | +0,986 +1,359 +1,395 | ||
| 2ClO-+2H2O+2e=C12+4OH- C1O-+H2O+2e=C1-+2OH- C12O+4H++4e=2HC1+H2O HC1O+H++2e=C1-+H2O 2HC1O+2H++2e=C12(вод)+2H2O 2HC1O+2H++2e=C12+2H2O C12O+2H++2e=C12(вод)+H2O | +0,400 +0,880 +1,351 +1,500 +1,594 +1,630 +1,679 | |||
| C1O2-+H2O+2e=C1O-+2OH- C1O2-+2H2O+4e=C1-+4OH- HC1O2+3H++4e=C1-+2H2O 2HC1O2+6H++6e=C12+4H2O HC1O2+2H++2e=HC1O+H2O | +0,660 +0,770 +1,560 +1,630 +1,640 | |||
| C1O2+2H2O+5e=C1-+4OH- | +0,850 | |||
| Элемент | Электродный процесс | Е0, В | ||
| Хлор | C1O2+e=C1O2- C1O2+H++e=HC1O2 C1O2+5H++5e=HC1+2H2O C1O2+4H++5e=C1-+2H2O 2С1O2+8H++8e=C12+4H2O | +0,954 +1,270 +1,436 +1,500 +1,570 | ||
| C1O3-+H2O+2e=C1O2-+2OH- C1O3-+2H2O+4e=C1O-+4OH- 2C1O3-+3H2O+10e=C12+6OH- C1O3-+3H2O+6e=C1-+6OH- C1O3-+2H++e=C1O2+H2O C1O3-+3H++2e=HC1O2+H2O C1O3-+6H++6e=C1-+3H2O 2C1O3-+12H++10e=C12(вод)+6H2O 2C1O3-+12H++10e=C12+6H2O | +0,330 +0,475 +0,476 +0,630 +1,150 +1,210 +1,450 +1,463 +1,470 | |||
| C1O4-+H2O+2e=C1O3-+2OH- C1O4-+4H2O+8e=C1-+8OH- C1O4-+2H++2e=C1O3-+H2O C1O4-+8H++8e=C1-+4H2O 2C1O4-+16H++14e=C12+8H2O | +0,360 +0,560 +1,190 +1,380 +1,390 | |||
| Хром | Cr(OH)2+2e=Cr+2OH- Cr2++2e=Cr | -1,400 -0,913 | ||
| Cr(OH)3+3e=Cr+3OH- CrO2-+2H2O+3e=Cr+4OH- Cr3++3e=Cr Cr(OH)3+3H++3e=Cr+3H2O Cr3++e=Cr2+ CrO2-+4H++3e=Cr+2H2O CrO2-+4H+e=Cr2++2H2O | -1,300 -1,200 -0,744 -0,654 -0,407 -0,213 +1,188 | |||
| CrO2+4H++e=Cr3++2H2O | +1,48 | |||
| Cr(OH)3(т)+e=Cr(OH)2(т)+OH-
CrO42-+4H2O+3e=[Cr(OH)6]3-+2OH-
CrO42-+4H2O+3e=Cr(OH)3+5OH-
CrO42-+4H2O+3e=Cr(OH)3+5OH-
C2O72-+14H++12e=2Cr+7H2O
H2CrO4
– Конец работы – Эта тема принадлежит разделу: Физико-химические характеристикиКурский государственный технический университет... Кафедра химии... Физико химические характеристики... Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Стандартные электродные потенциалы в водных растворах Что будем делать с полученным материалом:Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Хотите получать на электронную почту самые свежие новости?
Подпишитесь на Нашу рассылку
Наша политика приватности обеспечивает 100% безопасность и анонимность Ваших E-Mail
Реклама |






Новости и инфо для студентов