рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Цепи митохондрий
Реферат Курсовая Конспект
Цепи митохондрий
Цепи митохондрий - раздел Химия, Гомбоева А.Ц., Никитина Л.П., Хышиктуев Б.С. Биохимия. Энергетика общих путей катаболизма. Учебное пособие Название Локализация, Состав, Фун...
| Название | Локализация, состав, функции | Редокс–центры |
| Комплекс I (НАДН – убихинон-редуктаза) | Трансмембранный комплекс из 25 субъединиц. Предназначен для окисления молекул НАДН, продуцируемых растворимыми матриксными дегидрогеназами. | 1 ФМН 4 FeS-белка |
| Комплекс II (сукцинат-убихинон–редуктаза) | Состоит из серии субъединиц, внедренных во внутреннюю мембрану со стороны матрикса; переносит 2ē и 2Н+ от сукцината на мобильный убихинон липидного бислоя. | 1 ФАД 3 FeS-белка 1 гем b |
| Комплекс III (цитохром bc1; убихинон–цитохром–с–редуктаза) | Трансмембранный белок из 11 субъединиц, включает цитохромы b, c1 и FeS-белок. Они образуют цепочку поочередного транспорта каждого электрона от КоQ·Н2 на цитохром с, примыкающего к мембране. | 3 гем b 1 FeS-белок |
| Комплекс IV (цитохромоксидаза) | Ансамбль из 6 субъединиц. Из них каталитическая содержит не только два гема, но и ионы меди (Сu2+В, Сu2+А), она обеспечивает поток электронов от цитохрома c снаружи мембраны на молекулу кислорода в матриксе. | 1 гем а 1 гем а3 1 Сu2+А 1 Сu2+В |
| F0-F1-АТФ-синтаза | Сложная молекулярная машина включает два субкомплекса: факторы F0 и F1 (протонтранспортирующая двухсекторная АТФ–аза). |
Структура НАД+, установленная Г. Эйлер-Хельпиным с соавторами, представляет динуклеотид, в котором мономеры объединены друг с другом ангидридной связью. Одним мононуклеотидом является АМФ, в другом в качестве азотистого основания выступает амид никотиновой кислоты (рис. 6).

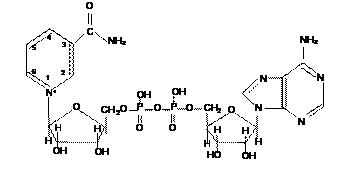
Рис. 6. Строение никотинамидадениндинуклетида (НАД+)
Окисленная форма НАД+ включает в себя катион пиридиния (=N+=), в котором смещается π-электронная плотность сопряженной ароматической системы, делая С4 сильным электрофилом, благодаря этому гидрид ион (Н‾ ) отрывается от субстрата и присоединяется к С4, происходит восстановление. В результате нарушается ароматичность пиридиниевого ядра, следствием чего и является повышение энергии восстановленной формы (НАДН) по сравнению с его окисленной.. Субстрат, лишившись гидрид иона, теряет устойчивость; для стабилизации от него отщепляется протон (рис. 7).
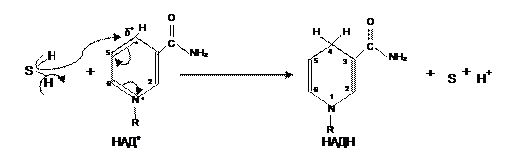
Рис. 7. Схема действия кофермента НАД+
Комплекс I катализирует суммарную реакцию восстановления убихинона (КоQ), сопряженную с трансмембранным переносом протонов (nН+) из матрикса митохондрий в межмембранное пространство:
 НАДН + Н+ + КоQ + nН+матр. НАД+ + КоQH2 + nН+межмемб.
НАДН + Н+ + КоQ + nН+матр. НАД+ + КоQH2 + nН+межмемб.
|

Далее электроны и протоны переходят к железосерным центрам Fe-S комплекса I, которые в конечном итоге и передают электроны на убихинон.
Если величина редокс–потенциала окисляемого субстрата выше – 0,32 вольт, тогда роль первичного акцептора выполняет комплекс II: сукцинат-убихинон-редуктаза, содержащая в качестве кофермента ФАД (флавинадениндинуклеотид), который синтезируется в клетке из ФМН путем переноса АМФ от молекулы АТФ. К таким энзимам принадлежат сукцинатдегидрогеназа (окисление янтарной кислоты в цикле Кребса), ацил-КоА-дегидрогеназа (подобное преобразование жирной кислоты в β-окислении), глицерол-1-фосфатдегидрогеназа (распад глицерина), в результате действия которых водород окисляемого субстрата, минуя НАД+, восстанавливает ФАД.

 Рис. 9. Схема действия ФМН (ФАД)
Рис. 9. Схема действия ФМН (ФАД)
Второй комплекс осуществляет перенос восстановительных эквивалентов от ФАДН2 (кофермент сукцинатдегидрогеназы) через Fe-S центры на убихинон, локализованный в липидном слое внутренней мембраны митохондрий (рис. 10).

Рис. 10. Схема превращения убихинона
Комплекс Ш: убихинон-цитохром–с-редуктаза, называемый также комплексом цитохромов bс1, осуществляет перенос электронов от восстановленного убихинона (КоQH2) на цитохром с. Это сопровождается трансмембранным –переносом протонов из митохондриального матрикса в межмембранное пространство.
Процесс передачи электронов от двухэлектронного переносчика убихинона к одноэлектронным – цитохромомам осуществляется в сложной цепи реакций, названных Q–циклом. В сильно упрощенном виде Q-цикл можно представить следующим образом (рис. 11).
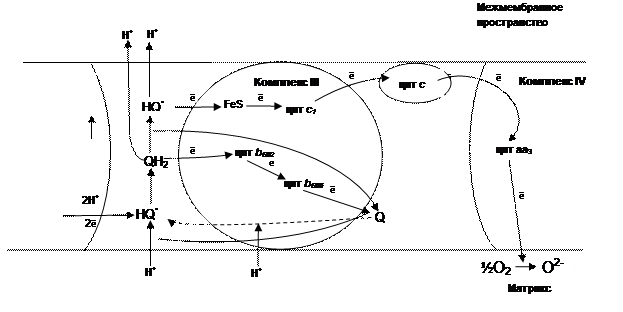
Рис. 10. Схема Q–цикла
Восстановленный в результате работы Комплексов I и II убихинон (КоQH2) диффундирует к наружной стороне внутренней мембраны, отдавая один электрон (через цитохром с1) на восстановление цитохрома с и освобождая в межмембранное пространство два протона. Образующееся при этом промежуточное соединение семихинон-радикал (КоQH•) передает второй электрон цитохрому b, который затем используется на восстановление других молекул КоQ (рис.11).
Несмотря на сложный путь движения электронов в комплексе III, окончательный результат прост: КоQH2 окисляется, а цитохром с - восстанавливается. При этом перенос одного электрона от КоQH2 к данному гемопротеину сопровождается выделением двух протонов (Н+) в пространство между мембранами, поэтому принято считать, что полное окисление одной молекулы КоQH2 протекает с восстановлением двух молекул цитохрома с и переносом четырех протонов из матрикса митохондрий в межмембранное пространство:
 КоQH2+2цит с (Fе3+) + 4Н+матр КоQ + 2цит с (Fe2+) + 4Н+межмемб.
КоQH2+2цит с (Fе3+) + 4Н+матр КоQ + 2цит с (Fe2+) + 4Н+межмемб.
Комплекс IV: цитохромоксидаза катализирует реакцию окисления восстановленного цитохрома с молекулярным кислородом, сопряженную с трансмембранным переносом протонов. Этот сложный олигомерный белок имеет в своем составе два гема (а и а3) и два иона Сu2+, обозначаемые как Сu2+А и Сu2+В. Электрон, полученный от цитохрома с, переносится на Сu2+А. Двигаясь в направлении от цитоплазматической поверхности вглубь мембраны, электрон перемещается от Сu2+А к гему а и далее к гему а3 и Сu2+B – последнему компоненту дыхательной цепи, восстанавливающему О2:
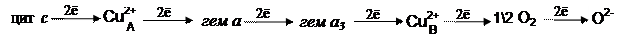
Таким образом, транспорт восстановительных эквивалентов от НАДН к кислороду сопровождается переносом катионов водорода из матрикса в межмембранное пространство (рис. 3), где создается трансмембранный градиент их концентрации: снаружи их в 10 раз больше, чем в матриксе. Возникающий градиент электрохимического потенциала ∆μН+ является движущей силой, стремящейся вернуть протоны обратно, чтобы устранить резкий перепад их величин. Однако возвратное движение ионов Н+ возможно только через специальные трансмембранные каналы (протонтранспортирующая двухсекторная АТФаза – F0-F1-АТФ-синтаза).
– Конец работы –
Эта тема принадлежит разделу:
Гомбоева А.Ц., Никитина Л.П., Хышиктуев Б.С. Биохимия. Энергетика общих путей катаболизма. Учебное пособие
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ... ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Цепи митохондрий
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов