рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Автокатализ.
Реферат Курсовая Конспект
Автокатализ.
Автокатализ. - раздел Химия, Влияние температуры на скорость химической реакции Сл.13(0)Автокатализ – Процесс Каталитического Ускорен...
СЛ.13(0)Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов. В качестве примера можно привести катализируемую ионами водорода реакцию гидролиза сложных эфиров. Образующаяся при гидролизе кислота диссоциирует с образованием протонов, которые ускоряют реакцию гидролиза. Особенность автокаталитической реакции состоит в том, что данная реакция протекает с постоянным возрастанием концентрации катализатора. Поэтому в начальный период реакции скорость её возрастает, а на последующих стадиях в результате убыли концентрации реагентов скорость начинает уменьшаться; кинетическая кривая продукта автокаталитической реакции имеет характерный S-образный вид (рис. 6СЛ.13(1)).
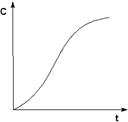
Рис. 6 Кинетическая кривая продукта автокаталитической реакции
– Конец работы –
Эта тема принадлежит разделу:
Влияние температуры на скорость химической реакции
Классификация химических реакций самостоятельно... Скорость химической реакции... Влияние температуры на скорость химической реакции...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Автокатализ.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов