рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Гетерогенный катализ.
Реферат Курсовая Конспект
Гетерогенный катализ.
Гетерогенный катализ. - раздел Химия, Влияние температуры на скорость химической реакции Сл.14(0) Гетерогенный Катализ – Каталитические Реакци...
СЛ.14(0) Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа. СЛ.14(1) В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
СЛ.14(2) 2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:
А + В + К ® АВК
СЛ.14(3) 3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):
АВК ® АВК#
СЛ.14(4) 4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:
АВК# ® СDК
СЛ.14(5) 5. Десорбция продуктов реакции с поверхности катализатора.
СDК ® С + D + К
СЛ.14(6) 6. Диффузия продуктов реакции от поверхности катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
СЛ.15(0) Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции
СО + Н2 ––> СН4 + Н2О
введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
СЛ.15(1) Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.
Для объяснения этих особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано следующее предположение: каталитически активной является не вся поверхность катализатора, а лишь некоторые её участки – т.н. активные центры, которыми могут являться различные дефекты кристаллической структуры катализатора (например, выступы либо впадины на поверхности катализатора). В настоящее время нет единой теории гетерогенного катализа. Для металлических катализаторов была разработана теория мультиплетов. СЛ.16(0) Основные положения мультиплетной теории состоят в следующем:
СЛ.16(1) 1. Активный центр катализатора представляет собой совокупность определенного числа адсорбционных центров, расположенных на поверхности катализатора в геометрическом соответствии со строением молекулы, претерпевающей превращение.
СЛ.16(2) 2. При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перераспределение связей, приводящее к образованию продуктов реакции.
Теорию мультиплетов называют иногда теорией геометрического подобия активного центра и реагирующих молекул. Для различных реакций число адсорбционных центров (каждый из которых отождествляется с атомом металла) в активном центре различно – 2, 3, 4 и т.д. Подобные активные центры называются соответственно дублет, триплет, квадруплет и т.д. (в общем случае мультиплет, чему и обязана теория своим названием).
Например, согласно теории мультиплетов, дегидрирование предельных одноатомных спиртов происходит на дублете, а дегидрирование циклогексана – на секстете (рис. 7 СЛ.17).
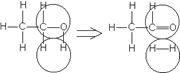 а
а
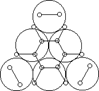 б
б
– Конец работы –
Эта тема принадлежит разделу:
Влияние температуры на скорость химической реакции
Классификация химических реакций самостоятельно... Скорость химической реакции... Влияние температуры на скорость химической реакции...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гетерогенный катализ.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов