Промышленное производство органических соединений - раздел Химия, ХИМИЯ Возрастающая Роль Органических Соединений В Современном Мире Вызывает Потребн...
Возрастающая роль органических соединений в современном мире вызывает потребность в создании промышленного производства, способного производить их в достаточном количестве. Для такого производства необходимы доступные, дешевые и широко распространенные в природе источники сырья, из которою можно было бы получать необходимые соединения. Выяснилось, что этим требованиям удовлетворяют три ископаемых источника сырья, а именно: каменный уголь, природный газ и нефть.
Первое сырье для производства органических материалов было получено сухой перегонкой (карбонизацией, пиролизом) каменного угля, т.е. нагреванием угля без доступа воздуха. Продуктами такой сухой перегонки являются в основном ароматические углеводороды и их производные; из них получали, прежде всего, синтетические красители, и производство красителей стало первой большой отраслью промышленности органических материалов. Постепенно развивались и другие важные отрасли, как, например, промышленное сбраживание, переработка растительных и животных жиров и масел и т.д. Но с течением времени постоянно возрастало значение природного газа и нефти как источников химического сырья. Поэтому все шире разрабатывались и усовершенствовались соответствующие химические процессы. В настоящее время из природного газа и нефти получают свыше 90% всех синтезируемых органических соединений.
Лабораторные и промышленные способы получения. Между лабораторным и промышленным синтезом органических соединений имеется ряд принципиальных различий. Например, цена химикатов, использованных в лабораторном синтезе, обычно не имеет решающе го значения, поскольку синтез проводится в сравнительно малых масштабах. Поэтому при лабораторном восстановлении кетонов в спирты можно использовать дорогой алюмогидрид лития, в то время как в промышленности для этих целей применяют дешевые водород и никелевый катализатор. Другим примером дешевого реагента является кислород воздуха, с помощью которого в промышленности осуществляется ряд процессов каталитического окисления. Исходный материал для промышленных синтезов также должен быть дешевым и легкодоступным в больших количествах. Поэтому такой материал в большинстве случаев получают с помощью простейших методов из указанных выше источников сырья, прежде всего из природного газа и нефти. Применяемые растворители тоже должны быть дешевыми, а кроме того (по возможности) негорючими.
Другая проблема – работа с ядовитыми веществами. В лабораторном синтезе обычно можно использовать ядовитые соединения, работая в вытяжном шкафу или, в крайнем случае, в маске. Применение таких соединений в промышленном производстве крайне нежелательно, поскольку существует постоянно угроза утечки их в воздух или попадания в сточные воды.
В промышленности работают по возможности при нормальных или умеренно повышенных температурах, так как подвод тепла в больших количествах дорог. С другой стороны, в промышленности, вообще говоря, проще применять высокие температуры.
Другое важное различие заключается в том, что в лаборатории чаще всего работают с чистыми веществами, а на производстве обычно имеют дело со смесями. Аналогично при лабораторных синтезах стремятся получить чистый продукт, а в промышленных синтезах иногда удовлетворяются смесями, которые часто находят выгодное непосредственное применение (например, бензин). Если нужно разделить такие смеси, то используют всевозможные непрерывные процессы, которые хотя и требуют много времени (и поэтому обычно совершенно непригодны для применения в лаборатории), но зато эффективны. Другое большое достоинство промышленных процессов заключается в том, что при малом выходе продуктов можно организовать циклическое введение в процесс непрореагировавших исходных веществ и достичь, таким образом, практически полной их переработки. Такой процесс очень экономичен, но в лабораторных условиях осуществляется с большим трудом.
Из всех приведенных выше доводов ясно, что многие реакции, которые успешно протекают в лаборатории, практически неприменимы в химической промышленности и наоборот.
 Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ
Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ
CH4 + H2O → 3H2 + CO (700-900°C, Ni)
Газ аналогичного состава можно получить взаимодействием раскаленного кокса с водяным паром, откуда происходит название водяной газ:
C + H2O → H2 + CO (1000°C)
В частности, именно из оксида углерода (II) и водорода под давлением до 250 атм. в присутствии катализаторов получают метанол
CO + 2H2 → CH3OH
Природный газ обычно сопровождает залежи нефти, но имеются и самостоятельные месторождения газа.
Нефть представляет собой темную, маслянистую, не растворяющуюся в воде жидкость и содержит главным образом неразветвленные и разветвленные алканы, циклоалканы, а иногда и другие углеводороды (примерно до 50 атомов углерода в молекуле). Состав нефти зависит от месторождения. Использование природного газа и нефтепродуктов для получения энергии представляется неэффективным. Энергию можно получать и другим способом (без сжигания углеводородов), а вот подыскать замену природному газу и нефти как источникам химического сырья невозможно (об этом крайне эмоционально говорил еще Д.И. Менделеев!).
Хотя происхождение нефти и природного газа еще не выяснено во всех подробностях, бесспорно, что нефть образовалась при разложении растительных и животных остатков (в том числе и морского планктона) в течение долгих геологических периодов. Этот сложный процесс начался свыше миллиарда лет назад и протекал под действием микроорганизмов без доступа воздуха при повышенных температурах и давлениях.
Переработка нефти. Дробная перегонка «сырой» нефти приводит к ее разделению на фракции, кипящие в широком температурном интервале, а именно:
- углеводородный газ (пропан, бутан)
- бензиновая фракция, т.кип. до 200°C
- керосин, т.кип. 220-275°C
- газойль или дизельное топливо, т.кип. 200-400°C
- смазочные масла, т.кип. выше 300°C
- остаток (мазут)
В состав бензиновой фракции обычно входят петролейный эфир (т.кип. 20-60 °С) и так называемый экстракционный бензин (т.кип. 60-120 °С). Фракция, кипящая при температурах от 40 до 200 °С, называется бензином и относится к наиболее ценным нефтепродуктам, поскольку служит топливом для двигателей внутреннего сгорания. В бензине содержатся преимущественно углеводороды С6-С9. Керосин, содержащий углеводороды C9-C16, применяется в небольших отопительных устройствах, а также служит топливом для турбинных двигателей; пиролизуется (крекинг) до низших углеводородов. Газойль, или дизельное топливо, имеет подобное применение, но главным образом используется как топливо для дизельных двигателей. Смазочные масла (или нефтяные масла), содержащие углеводороды С20-С50, очищаются (рафинируются) и применяются в качестве смазочных материалов. Остаток после перегонки, мазут, используют как топливо или подвергают вакуумной перегонке, в результате которой получают следующую высококипящую углеводородную фракцию. Остатком является асфальт, служащий для покрытия мостовых.
Химические превращения углеводородов, содержащихся в нефти. Естественно, что при современном развитии автомобильного и авиационного транспорта потребность в бензине непрерывно возрастает. Поэтому было необходимо найти способы получения бензина из высококипящих фракций нефти. Такой способ найден и назван крекингом. Он заключается в том, что высшие алканы нагреваются до высоких температур без доступа кислорода. При этом происходит их расщепление на низшие алканы и алкены. В качестве примера приведем продукты, которые могут образоваться при крекинге н-гексана:

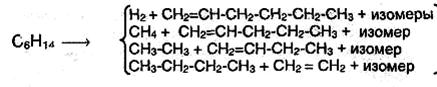
Если при крекинге не используется катализатор, а только повышенные температуры, то говорят о термическом крекинге. Этот процесс имеет радикальный механизм. Если же используется катализатор, например SiO2 и Аl2О3, то говорят о каталитическом крекинге, который имеет ионный механизм. При крекинге фракций нефти в огромных количествах образуются этен и пропен, поэтому оба этих вещества стали важным сырьем для промышленности органических материалов.
Для улучшения качества бензина были разработаны процессы, называемые риформингом или изомеризацией и алкилированием.
Основным моторным топливом в наше время является бензин. Прежде чем говорить о его качестве, обратим внимание на процессы, протекающие в цилиндрах бензинового двигателя.
В этом двигателе происходит сжигание предварительно сжатой смеси паров бензина и воздуха, подожженной электрической искрой. Смесь быстро сгорает с образованием диоксида углерода и воды, а также меньшего количества продуктов неполного окисления (в том числе оксида углерода (II)). Часть высвобожденной при горении энергии с помощью движения поршня превращается в механическую энергию.
Топлива для бензиновых двигателей имеют разные свойства. При использовании некоторых из них мотор работает нормально, а другие приводят к стуку мотора. Это означает, что сгорание протекает слишком быстро, т.е. вместо Спокойного горения произошла детонация и высвобожденная взрывом сила неправильно распределилась в сжатом пространстве Представителем непригодного топлива является гептан СН3(СН2)5СН3, в то время как 2,2,4-триметилпентан (часто называемый изооктаном), напротив, имеет в этом отношении уникальные свойства. Оба этих соединения были взяты за основу шкалы так называемых октановых чисел; гептану было по определению присвоено значение нуль, а «изооктану» – сто. Согласно этой шкале, например, бензин с октановым числом 90 имеет свойства смеси 90% «изооктана» и 10% гептана. Чем больше октановое число топлива, тем выше его качество. Некоторые соединения имеют октановое число больше 100.
Бензин, полученный из нефти простой перегонкой, имеет октановое число от 50 до 55 и непригоден для непосредственного использования в двигателях. Бензин более высокого качества получается при крекинге: его октановое число составляет 70-80. Поскольку для современных двигателей требуется топливо с октановым числом более 90, были разработаны методы улучшения бензинов, добываемых так называемым риформингом и алкилированием.
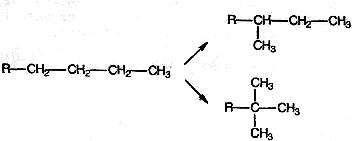
Риформинг заключается в изомеризации, при которой неразветвленные или малоразветвленные алканы при нагревании с подходящим катализатором превращаются в более разветвленные алканы с большим октановым числом, чем октановое число исходных алканов. Превращение неразветвленных алканов в разветвленные можно схематически представить следующим образом:
Алкилированием представляет собой ионную реакцию, катализируемую кислотами, при которой происходит объединение низших алканов и алкенов в высшие разветвленные, имеющие октановое число более высокое, чем октановые числа исходных углеводородов:
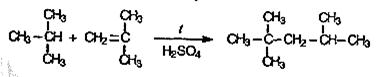
В течение десятилетий ароматические углеводороды получали сухой перегонкой каменного угля. Однако, вследствие усовершенствования нефтехимических процессов, в настоящее время большинство ароматических углеводородов получается из нефти.
Принцип получения ароматических углеводородов из нефти можно схематически представить на примере образования бензола. Гексан каталитически превращается в циклогексан, который дегидрируется в бензол (реакция циклизации с одновременным дегидрированием):
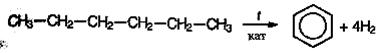
Аналогичным образом получают толуол и ксилолы.
В настоящее время из нефти получают более 90% всех органических соединений. В основе этого производства лежит превращение содержащихся в нефти углеводородов в ненасыщенные углеводороды, как, например, в этен, пропен, бутены и арены. Эти реакционно-способные углеводороды служат затем исходными веществами для большинства синтезов других соединений. Очень интересно получение смеси белков, образующейся при превращении некоторых фракций нефти под действием микроорганизмов.
Каменный уголь. Каменный уголь – это горючее ископаемое, образовавшееся в доисторическую эпоху в результате сложных процессов из отмерших остатков растений. В нем содержатся как органические, так и неорганические вещества. При сухой перегонке (карбонизации) угля, т.е. при нагревании до высоких температур без доступа воздуха, образуется сложная смесь твердых, жидких и газообразных продуктов. Газофазным продуктом является коксовый газ, содержащий прежде всего метан и водород. Жидким продуктом сухой перегонки является деготь. Из дегтя было выделено более 300 соединений, прежде всего фенол, крезолы, пиридин, нафталин, антрацен, тиофен и циклопентадиен-1,3. Твердый остаток сухой перегонки, кокс, имеет промышленное значение, для производства железа, ацетилена и водяного газа.
С учетом быстро возрастающей потребности в органических химикатах их получение из продуктов сухой перегонки каменного угля теряет значение, и преобладает нефтехимическое производство. Так, нафталин, типичный продукт сухой перегонки угля, теперь получается в основном из нефти, Однако процесс сухой перегонки сохраняет свое значение как источник кокса. Ожидается, что в ближайшем будущем значение каменного угля как химического сырья возрастет, потому что его мировые запасы существенно больше, чем запасы нефти. Снова исследуются забытые в течение десятков лет проблемы каталитического гидрирования угля с целью получения топлива для двигателей внутреннего сгорания.
Все темы данного раздела:
Часть I. ТЕОРЕТИЧЕСКАЯ ХИМИЯ
Глава 1. Основные понятия и законы химии................................................................................... 3
Глава 2. Строение атома и периодический закон.................
Часть II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 11. Важнейшие классы неорганических соединений...................................................... 55
Глава 12. Элементы I группы (водород, литий, натрий, подгруппа
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Глава 20. Общая характеристика органических соединений..................................................... 124
Глава 21. Алканы............................................
Основные положения атомно-молекулярной теории
1. Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом – наименьшая частица
Закон эквивалентов – для молекулярных соединений количество составляющих элементов пропорционально их химическим эквивалентам.
Эквивалент (Э)– частица вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одно
Газовые законы
Изучение свойств газообразных веществ и химических реакций с участием газов сыграло настолько важную роль в становлении атомно-молекулярной теории, что газовые законы заслуживают сп
Закон Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
Р1 / Т1 = Р2 / Т2, или Р/Т = const.
Эти три закона можно объединить в один универсальный газовый зако
Модели строения атома
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью (А. Беккерель, 1896 г.). Последовавшее за этим
Квантовые числа электронов
Главное квантовое число п определяет общую энергию электрона на данной орбитали (п = 1, 2, 3, ...). Главное квантовое число для атомов изве
Электронные конфигурации атомов
Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их эле
Принцип Паули или запрет Паули (1925 г.): в атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы один
Ядро атома и радиоактивные превращения
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Периодический закон
Открытый в 1869 г. Д.И. Менделеевым Периодический закон представляет собой один из фундаментальных законов в современном естествознании. Расположив все элементы в порядке возрастания атомных масс Д
Валентность и степень окисления
Способность атома химического элемента присоединять или замещать определенное число атомов другого элемента с образованием химической связи называется валентностью элемента.
Ковалентная связь – связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам.
Н·+ ·Н® Н : Н или Н – Н
Связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский лине
Связью можно назвать ковалентную связь, образованную при перекрывании атомных орбиталей вне линии, соединяющей атомы.
σ-связи являются более прочными, чем π-связи, чем объясняется большая реакционная способность непредельных углеводородов по сравнению с предельными.
Еще один вид г
Ионная связь
Ионная связь – электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов.
Na+
Металлическая связь
Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к
Межмолекулярные взаимодействия
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом.
Водородная связь – связь между положительно з
Единицы измерения температуры Т, давления р и объема V.
При измерении температуры чаще всего используются две шкалы. Абсолютная шкала температур использует в качестве единицы измерения кельвин (К). В абсолютной шкале нулевая точка (0 К) н
Химическая термодинамика
Химическая термодинамика отвечает на вопросы о принципиальной возможности протекания данной химической реакции в определенных условиях и о конечном равновесном состоянии системы
Реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту извне (Qp < 0) называются эндотермическими.
Так, окисление глюкозы кислородом происходит с выделением большого количества теплоты (Qp = 2800 кДж/моль), т.е. этот процесс – экзотермический. Соответствующее термохимическое у
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
v = ∆С / ∆τ моль/(л·с)
Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшими из них являются
Обратимые и необратимые реакции. Состояние химического равновесия
Химическая реакция не всегда «доходит до конца», т.е. исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия.
Так для обратимой химической реакции: aА + bВ
Идеальные и реальные растворы. Растворение как физико-химический процесс
Известны две основные теории растворов: физическая и химическая.
Физическая теория растворов предложена Вант-Гоффом и Аррениусом. Согласно этой теории, растворител
Зависимость растворимости различных веществ от природы растворителя, температуры и давления
Растворимость веществ в различных растворителях, например в воде, колеблется в широких пределах. Если в 100 г воды при комнатной температуре растворяется более 10 г веще
Законы разбавленных растворов
При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения раствора и понижение температуры
Способы выражения концентрации (состава) растворов
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», т.е. содержание растворенного вещества в единице массы или объема. 1.
1.
Электролиты и электролитическая диссоциация
Растворы, проводящие электрический ток, называются растворами электролитов.Существуют две основные причины прохождения электрического тока через проводники: либо за счет перен
Оптические и молекулярно-кинетические свойства дисперсных систем
Оптическое свойство коллоидных систем – опалесценция, т.е. рассеивание света малыми частицами, приводящее, в частности, к возникновению эффекта Фарадея-Тиндал
Поверхностные и адсорбционные явления
Различия состава и строения соприкасающихся фаз, а также характера молекулярных взаимодействий в их объеме обуславливают возникновение своеобразного молекулярного силового поля на поверхности разде
Коллоидные (коллоидно-дисперсные) системы
Коллоидные системы (золи) – это гетерогенные системы, состоящие из частиц размером порядка 10–7–10–9 м. По размеру частиц коллоидные системы занимают п
Окислительно-восстановительные реакции –реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ.
Степень окисления – условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит из ионов и в целом электронейтральна.
Вещество, в состав
Химические источники электрической энергии. Электродные потенциалы
Электрохимическую реакцию окисления-восстановления можно провести так, что электроны будут переходить от восстановителя к окислителю в виде электрического тока, т.е. будет происходить превращение х
Коррозия металлов
Коррозия – разрушение металлов в результате химического или электрохимического воздействия окружающей среды. Коррозия – самопроизвольный процесс, протекающий с уменьшением с
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через раствор или расплав электроли
Электролиз расплавов электролитов
Схема записи электролиза расплава электролита:
KtAn ↔ Ktn+ + Anm–
Катод– | Ktn+
Электролиз водных растворов электролитов
Электролиз растворов отличается от электролиза расплавов электролитов наличием молекул воды, которые также могут участвовать в окислительно-восстановительных реакциях электролиза. Вследствие своей
Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
Анодный процесс:
1. На нерастворимых анодах при конкуренции аниона бескислородных кислот (Cl–, Br–, I–, S2–
Качественный анализ
Задача качественного анализа –определение химического состава исследуемого соединения.
Качественный анализ проводят химическими, физическими и физико-химическим
Количественный анализ
Задача количественного анализа– определение количественного содержания химических элементов (или их групп) в соединениях.
Методы количественного ана
Кислоты
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+(по теории электролитич
Водород
Водород – первый элемент и один из двух представителей I периода Периодической системы. Атом водорода состоит из двух частиц – протона и электрона, между которыми существуют лишь силы притяжения. В
Бериллий
Во всех устойчивых соединениях степень окисления бериллия +2.
Содержание бериллия в земной коре невелико. Важнейшие минералы: берилл Be3Al2(SiO
Алюминий
Алюминий – типичный амфотерный элемент, для него наиболее типична степень окисления +3. В отличие от бора для него характерны не только анионные, но и катионные комплексы.
Лантаноиды
В семейство лантаноидов входят церий Се 4f25s25p65d06s2, празеодим Pr 4f3, неодим Nd 4f4, прометий
Актиноиды
В семейство актиноидов входят торий Th 5f06s26p66d27s2, протактиний Pr 5f2 6d17s2
Углерод
В большинстве неорганических соединений углерод проявляет степени окисления –4, +4, +2.
В природе содержание углерода составляет 0,15% (мол. доли) и находится в основном в
Кремний
Кремний в соединениях имеет степени окисления +4 и –4. Для него наиболее характерны связи Si–F и Si–О.
По распространенности на Земле 20% (мол. долей) кремний уступает то
Кислород
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Степень окисления кислорода в подавляющем большинстве соединений равна –2. Кром
Формулы органических соединений
Молекулярная формула отражает качественный и количественный элементный состав вещества. В молекулярной формуле сначала пишут атомы углерода, затем - атомы водорода, затем -
Номенклатура органических соединений
В настоящее время признана систематическая номенклатура ИЮПАК (IUРАС – Международный союз теоретической и прикладной химии). Среди вариантов
Изомерия органических соединений
Изомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединят
И реакционная способность органических соединений
Химические свойства атомов, входящих в молекулы, меняются в зависимости от того, с какими другими атомами они связаны. Наиболее сильно влияют друг на друга непосредственно связанные атомы, однако
Общая характеристика органических реакций
В основу классификации органических реакций могут быть положены различные принципы.
I. Классификация химических реакций по результату химического превращения:
1.
Номенклатура и изомерия
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты (полностью «насыщены») атомами водорода. Простейшим пр
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17 ) – жидкости
Способы получения
Основные природные источники алканов – нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метан
Химические свойства
В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными ще
Номенклатура и изомерия
Циклоалканы – это предельные циклические углеводороды. Простейшие представители этого ряда:
Обща
Химические свойства
Похимическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и
Номенклатура и изомерия
Алкенами называют непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса – этилен СН2=СН2,
Получение
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным исто
Химические свойства
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными
Применение
Низшие алкены – важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола,
Номенклатура и изомерия
Алкадиены – непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цеп
Получение
Основной промышленный способ получения диенов – дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
Химические свойства
Для алкадиенов характерны обычные реакции электрофилъного присоединения АЕ, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их
Номенклатура и изомерия
Алкинами называют непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула гомологического ряда алкинов СnН2
Физические свойства
Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) – газы, (C5 – C16) – жидкости, начиная с С17
Получение
1. Общий способ получения алкинов – отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под
Химические свойства
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE
Применение
На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетиле
Номенклатура и изомерия
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с ос
Физические свойства
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хор
Способы получения
1. Получение из алифатических углеводородов. Для получения бензола и его гомологов в промышленности используют ароматизацию предельных углеводородов, входящих в состав нефти. При про
Химические свойства
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-
Правила ориентации (замещения) в бензольном кольце
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах
Применение
Ароматические углеводороды – важнейшее сырье для синтеза ценных веществ. Из бензола получают фенол, анилин, стирол, из которых, в свою очередь, получают фенолформальдегидные смолы, красители, полис
Номенклатура и изомерия
Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная гру
Получение
1. Общий способ получения спиртов, имеющий промышленное значение, – гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором (H3PO
Химические свойства
Химические свойства спиртов определяются присутствием в их молекулах группы -ОН.
Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участие
Реакции с разрывом связи О–Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
Реакции с разрывом связи С–О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
Применение
Спирты главным образом используют в промышленности органического синтеза.
Метиловый спиртСН3ОН – ядовитая жидкость температурой кипения 65°С, легко смешивается
Химические свойства
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в
Применение
Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах его используют также для получения диоксана, важного (хотя и токсичного) лабораторно
Физические свойства
Фенолы в большинстве своем – кристаллические вещества (мета-крезол – жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде,
Способы получения
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
Химические свойства
В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую π-систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кол
Номенклатура и изомерия
Органические соединения, в молекуле которых имеется карбонильная группа, называют карбонильным
Получение
1. Гидратация алкинов. Из ацетилена получают альдегид, из его гомологов – кетоны:
Из-за
Химические свойства
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью.
Альдегиды и кетоны – химически активные соединения
Применение
Формальдегид – газ с резким раздражающим запахом. 40% водный раствор формальдегида называется формалином. Формальдегид получают в промышленности в крупных масштабах окислением метана или метанола
Номенклатура и изомерия
Карбоновыми кислотами называют соединения, содержащиекарбоксильную группу
Физические свойства
Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1COOH. Низшие члены этого ряда при обычны
Получение
1. Окисление первичных спиртов – общий способ получения карбоновых кислот. В качестве окислителей применяют КМnО4 и К2Сr2O7.
Химические свойства
Карбоновые кислоты – более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы –СО. В водном растворе карбоновые ки
Применение
Насыщенные кислоты. Муравьиная кислота НСООН. Название связано с тем, что кислота содержится в выделениях муравьев. Широко применяется в фармацевтической и пищевой промышле
Номенклатура и изомерия
Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры – соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен
Физические свойства
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, наприме
Химические свойства
1. Реакция гидролиза или омыления.
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результат
Жиры и масла
Среди сложных эфиров особое место занимают природные эфиры – жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами с неразветвленной углеродно
Номенклатура и изомерия
Простейший моносахарид – глицериновый альдегид, С3Н6О3:
Осталь
Физические и химические свойства глюкозы
Глюкоза С6Н12О6 представляет собой белые кристаллы, сладкие на вкус, хорошо растворимые в воде. В линейной форме молекулы глюкозы содержат одну аль
Дисахариды
Важнейшие дисахариды – сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно.
Молек
Полисахариды
Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Общая формула полисахаридов (С6Н10О5)n. Мы рассмотрим важнейшие пр
Номенклатура и изомерия
Общая формула предельных алифатических аминов CnH2n+3N.
Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и доба
Физические свойства
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэ
Получение
1. Основной способ получения аминов – алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком:
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов име
Ароматические амины
Анилин (фениламин) C6H5NH2 – родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Эта св
Физические свойства
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворима в воде, растворима в этиловом спирте и в бензоле.
Основной способ получения анилина – восстановление нитроб
Химические свойства
1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает осн
Номенклатура и изомерия
Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа –СООН и аминогруппа –NH2. В зависимости от взаимного расположения обеих функци
Химические свойства
Аминокислоты – это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную гру
Пептиды
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продук
Химические свойства
1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности с
Биологическое значение белков
Биологическое значение белков чрезвычайно велико.
1.Абсолютно все химические реакции в организме протекают в присутствии катализаторов – ферментов. Даже такая простая реакци
Шестичленные гетероциклы
Пиридин C5H5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН за
Пятичленные гетероциклы
Пиррол C4H4NH – пятичленный гетероцикл с одним атомом азота.
Строение нуклеиновых кислот
Нуклеиновые кислоты – это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекуля
Биологическая роль нуклеиновых кислот
ДНК – главная молекула в живом организме. Она хранит генетическую информацию, которую передает от одного поколения к другому. В молекулах ДНК в закодированном виде записан состав всех белков орган
Цитозин гуанин
Таким образом, информация, содержащаяся в ДНК, как бы перепечатывается в мРНК, а последняя доставляет ее в рибосомы.
2. Транспортная РНК (тРНК) переносит аминокислоты к рибосомам,
Общая характеристика полимеров
Довольно часто общую формулу полимеров можно записать в виде (-Х-)n, где фрагмент -Х- называется элементарное звено, а число n – степень полимериза
Пластмассы
Пластмассами называют материалы на основе полимеров, способные изменять свою форму при нагревании и сохранять новую форму после охлаждения. Благодаря этому свойству пластмассы легко поддаются меха
Волокна
Одна из важных областей применения полимеров – изготовление волокон и тканей.
Рассмотрим два ва
Каучуки
Каучуки – продукты полимеризации диенов и их производных.
Натуральный каучук получают из латекса – сока некоторых тропических растений. Его строение можно установит
 Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ
Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ


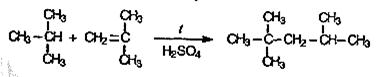
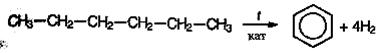







Новости и инфо для студентов