КУРС ЛЕКЦИЙ ПО ОБЩЕЙ БИОХИМИИ
ГОУВПО УГМА Федерального агентства по здравоохранению и социальному развитию
Кафедра биохимии
КУРС ЛЕКЦИЙ
ПО ОБЩЕЙ БИОХИМИИ
Модуль 5. Биохимия белков и аминокислот
Автор: к.б.н., доцент кафедры биохимии Гаврилов И.В.
Екатеринбург,
2009г
ЛЕКЦИЯ № 17
Тема: Белки I. Механизмы переваривание и всасывания белков
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
ПОНЯТИЕ, КЛАССИФИКАЦИЯ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
Белки – высокомолекулярные органические соединения, состоящие из остатков более чем 100 АК. У человека в организме содержится 15кг белка. По количеству генов, у человека предполагают наличие около 50000 видов белков. Самый распространенный белок у человека - коллаген, на его долю приходиться 30% от общего содержания белка.
Пептиды - органические соединения, состоящие из остатков от 2 до 100 АК.
Олигопептиды - органические соединения, состоящие из остатков от 2 до 10 АК.
Полипептиды - органические соединения, состоящие из остатков от 10 до 100 АК.
Белки имеют 3-4 уровня организации:
1. Первичная структура линейна, представлена последовательностью аминокислот, соединенных пептидными связями;
2. Вторичная структура является пространственной, она образуется только водородными связями. Выделяют α-спираль и β-складчатый лист;
3. Третичная структура является пространственной, она образуется ковалентными, водородными, ионными и гидрофобными связями. Образует белковые глобулы;
4. Четвертичная структура является пространственной, она образуется при соединении нескольких белковых глобул слабыми водородными, ионными и гидрофобными связями;
Разрушение первичной структуры белка называется гидролиз. Гидролиз пептидной связи идет в кислой и щелочной среде и с участием ферментов пептидаз (класс гидролаз).
Разрушение вторичной, третичной и четвертичной структур называется денатурацией. Денатурация бывает обратимой, когда разрушаются слабые связи (водородные, ионные, гидрофобные) и необратимой, когда разрушаются прочные связи (ковалентные).
Классификация белков
· По составу белки делятся на простые (протеины) и сложные (протеиды). Простые белки содержат только остатки аминокислот. Сложные белки, кроме аминокислот, содержат небелковый компонент: липиды, углеводы, нуклеиновые кислоты, металлы, витамины, порфирины и т.д.
· По форме белки делятся на глобулярные и фибриллярные. Глобулярные белки содержат α-спираль, они как правило водорастворимы. Фибриллярные белки содержат β-складчатую структуру и водонерастворимы (кератин);
· Белки делятся по выполняемым в организме функциям.
Функции белков
- Структурная (коллаген, эластин, кератин);
- Каталитическая (ферменты);
- Транспортная (гемоглобин, альбумины, глобулины);
- Сократительная (актин, миозин);
- Защитная (иммуноглобулины, фибриноген, плазминоген, лизоцим);
- Регуляторная (гормоны, рецепторы);
- Онкотическое давление (белки сыворотки крови);
- Буферная (гемоглобин, белки сыворотки крови).
Свойства белков
- Белки в основном водорастворимые вещества, образующие коллоидный раствор;
- Белки способны к денатурации и гидролизу;
- Обладают амфотерными свойствами;
- Проявляют оптическую активность, т.к. состоят из оптически активных L-аминокислот.
РОЛЬ БЕЛКА В ПИТАНИИ. ПОКАЗАТЕЛИ КАЧЕСТВА ПИЩЕВОГО БЕЛКА
Богаты белками продукты животного происхождения: мясо, рыба, сыр. Продукты растительного происхождения содержат, как правило, мало белка (кроме… Количество белка в некоторых пищевых продуктах Название продукта … Питательная ценностьбелка зависит от его аминокислотного состава и способности усваиваться организмом.АЗОТИСТЫЙ БАЛАНС. ПРИНЦИПЫ НОРМИРОВАНИЯ БЕЛКА В ПИТАНИИ. БЕЛКОВАЯ НЕДОСТАТОЧНОСТЬ
Нулевой азотистый баланс существует, когда количество выделяемого азота равно количеству поступающего в организм.Он характерендля здорового… Положительный азотистый баланс существует, когда из организма выделяется… Отрицательный азотистый баланс существует, когда из организма выделяется больше азота, чем поступает. Наблюдают при…Нормы белка в питании
· Для здорового взрослого человека оптимальное количество белка в пище составляет - 100-120 г/сут (или не менее 1г/кг в сут). · Детям до 12 лет достаточно 50 - 70 г/сут (4,0-1,5 г/кг в сут) (до 3… · Для детей от 12- 15 лет оптимальное количество белка в пище составляет - 100-120 г/сут.Белковая недостаточность
У животных при отсутствии цистеина возникает острый некроз печени, гистидина — катаракта; отсутствие метионина приводит к анемии, ожирению и… Заболевание «Квашиоркор», в переводе означает «золотой (или красный)… Заболевание развивается у детей, которые лишены молока и других животных белков, а питаются исключительно…ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖКТ
Всасывание – процесс поступления веществ из просвета ЖКТ в кровеносное русло. В пищевых продуктах содержатся в основном белки и пептиды, которые, как… Переваривание белков и пептидов в ЖКТ происходит под действием пищеварительных соков, содержащих ферменты протеазы,…ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ
Основная пищеварительная функция желудка – переваривание белка. Для пищеварения слизистая оболочка желудка выделяет сложный по составу сок, который…Состав желудочного сока
Главные клетки вырабатывают пепсиногены (пепсин, гастриксин, реннин), обкладочные (париетальные) — соляную кислоту, добавочные и мукоциты —…Кислотность желудочного сока
Кислотность желудочного сока связана с наличием в нем различных неорганических (HCl, кислые фосфаты) и органических (оксо-, окси-, амино-, нуклеиновые, жирные кислоты и т.д.) кислот. В связи с этим выделяют понятие общая кислотность желудочного сока. Основная причина кислотности желудочного сока связана с наличием в нем соляной кислоты. Соляная кислота в желудочном соке находится в свободном и в связанном (с белками и продуктами их переваривания) состоянии.
Механизм образования соляной кислоты
Н2СО3 диссоциирует на бикарбонат, который выделяется в плазму крови в обмен на С1-, и Н+, который активно переносится Н+/К+-АТФ-азой в просвет… При этом в просвете желудка концентрация Н+ увеличивается в 106 раз,… Вода выходит из клеток в просвет желудка по осмотическому градиентуФерменты желудка
В просвете желудка под действием НС1 от N-конца пепсиногена отщепляется пептид в 42 аминокислотных остатка, который содержит почти все положительно… Пепсин – эндопептидаза, с молекулярной массой 32,7 кД и с оптимумом… Гастриксин – эндопептидаза, с оптимумом рН=3,2-3,5. Образуется из пепсиногена, гидролизует внутренние пептидные связи…Нарушения переваривания белков в желудке
При заболеваниях желудка в желудочном соке часто происходит изменение содержание соляной кислоты, реже - снижение активности пищеварительных ферментов, что приводит к нарушению процессов переваривания белков.
Для диагностики заболеваний желудка определяют кислотность желудочного сока, содержание в нем свободной и связанной HCl, пепсина, фактора Касла и наличие патологических компонентов: молочной кислоты и крови.
Определение кислотности желудочного сока
В качестве нарушений выделяют: Повышенная кислотностьжелудочного сока. Она обычно сопровождается изжогой,… Пониженная кислотностьжелудочного сока. Бывает при некоторых видах гастритов.ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ
Размельченные и химически обработанные пищевые массы в смеси с желудочным соком образуют жидкий или полужидкий химус, который поступает в… Переваривание белков происходит в кишечнике под действием пищеварительных…Панкреатический сок
В соке содержится 5-6г общего белка, катионы Na+ (134-142 мг/л), Ca2+, К+ (4,7-7,4 мг/л), Мg2+ и анионы Cl- (35-97 мг/л), SO32-, HPO42-, особенно… Ферментная часть секрета образуется в ацинарных клетках, а жидкая… В панкреатическом соке содержится большое количество гидролитических ферментов: липаз, фосфолипаз, эстераз, нуклеаз,…Специфичность действия протеаз
Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В — цинксодержащие ферменты, отщепляют аминокислоты с… Поджелудочный сок обеспечивает в просвете кишки полостное переваривание. Ферменты поджелудочной железы гидролизуют…Возрастные особенности панкреатического сока
Протеолитическая активность пищеварительного сока поджелудочной железы находится на довольно высоком уровне уже с первых месяцев жизни, достигая максимума к 4-6 годам. Липолитическая активность увеличивается в течение первого года ребенка. Активность поджелудочной амилазы к концу первого года жизни возрастает в 4 раза, достигая максимальных значений к 9 годам.
Кишечный сок
Основной компонент кишечного сока - вода, в которой растворены органические (белки, аминокислоты, промежуточные продукты обмена, слизь) и… В кишечном соке содержится более 20 ферментов, гидролизующих углеводы… Экзопептидазы (аминопептидазы, три- и дипептидазы) синтезируются кишечником сразу в активной форме, они гидролизуют…Защита клеток от действия протеаз
· эти ферменты образуются в клетках поджелудочной железы в неактивной формеи активируются только после секреции в просвет кишечника. · в клетках поджелудочной железы присутствует белок-ингибитор… В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем…РЕГУЛЯЦИЯ ЖЕЛУДОЧНО-КИШЕЧНОЙ СЕКРЕЦИИ
Регуляция секреции желудочного сока осуществляется в 3 фазы: 1. Мозговая (сложнорефлекторная) фаза. Осуществляется через комплекс условных… 2. Желудочная (нейро-гуморальная) фаза. Возникает при нахождении пищи в желудке. За счет вагуса, метасимпатической…Регуляция поджелудочной секреции
1. Мозговая (сложнорефлекторная) фаза. Осуществляется через комплекс условных и безусловных рефлексов. Вид, запах и вкус пищи активируют нейроны… 2. Желудочная (нейро-гуморальная) фаза. Возникает при нахождении пищи в… 3. Кишечная фаза. Кислый химус вызывает в кишечнике выделение S-клетками секретина (белковый гормон). Секретин…Регуляция кишечной секреции
Мотилин (в Мо-клетках) - стимулирует активность гладко-мышечной клеток кишечника.ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ
Известно пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: … 1. нейтральных, короткой боковой цепью (аланин, серии, треонин); 2. нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);Глутамильный цикл.
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Мембранно-связанный фермент… Дипептид цистеинилглицин расщепляется под действием пептидазы на 2…НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ БЕЛКОВ И ТРАНСПОРТА АМИНОКИСЛОТ
У новорожденных проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь поступают белки (антитела) молозива, необходимые… При заболевании целиакии (нетропической спру)происходит нарушение клеток… Цистинурия,болезнь Хартнапаи некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в…ГНИЕНИЕ
В аэробных условиях белковые молекулы подвергаются более глубокому распаду с образованием множества промежуточных продуктов, распад идет вплоть до… В анаэробных условиях образуется меньше продуктов распада, но они являются… При распаде цистеина, цистина и метионина образуются таурин (C2H7NO3S), этилсульфид (C4H10S), метилмеркаптан (CH3-SH),…ЛЕКЦИЯ № 18
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический. 2 курс. Аминокислоты (АК) – органические соединения, содержащие… Всего известно около 300 видов АК, у человека в организме - 70, а в составе белков - 20.Физико-химические свойства аминокислот
АК амфотерные вещества – проявляют свойства кислот и оснований. К наиболее важным общим реакциям АК относятся реакции: 1. декарбоксилирования,Функции аминокислот
- Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других аминокислот
- Служат источником азота при синтезе всех азотсодержащих небелковых соединений (нуклеотиды, гем, креатин, холин и др);
- Выполняют регуляторную функцию (гли, глу - нейромедиаторы);
- служат источником энергии для синтеза АТФ.
ПУТИ ОБРАЗОВАНИЯ ПУЛА АМИНОКИСЛОТ В КРОВИ
И ЕГО ИСПОЛЬЗОВАНИЕ В ОРГАНИЗМЕ
Источниками АК в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на АК около 400г белков,…ОБЩИЕ РЕАКЦИИ ОБМЕНА АМИНОКИСЛОТ
АК, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена АК относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (L переходы D).
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ
Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина). … У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме…Механизм переаминирования
Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат. Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает…Органоспецифичные аминотрансферазы АЛТ и АСТ
Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза… АЛТ катализирует реакцию трансаминирования между ала и α-КГ:… ACT катализирует реакцию трансаминирования между асп и α-КГ: асп+α-КГ↔ЩУК+глуБиологическое значение трансаминирования
Реакции трансаминирования обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование АК
Существует 5 видов прямого дезаминирования АК: окислительное; неокислительное; внутримолекулярное; восстановительное; гидролитическое. Окислительное дезаминирование -самый активный вид прямого дезаминирования… 1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит…Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:
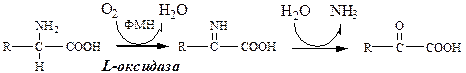
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
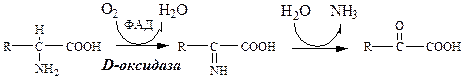
Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.
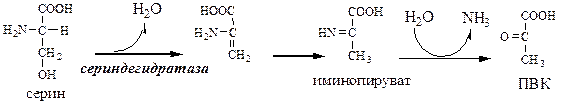
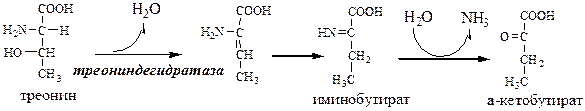
Внутримолекулярное дезаминирование
Непрямое дезаминирование (трансдезаминирование)АКНепрямое дезаминирование в печени
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм… При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм АК и образование а-кетоглутарата, поступающего в…Непрямое дезаминирование в мышцах (и нервной ткани)
Можно выделить 4 стадии этого процесса: трансаминирование с… Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная…Пути обмена безазотистого остатка аминокислот
Гликогенные аминокислоты - АК, которые превращаются в ПВК и промежуточные… Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА…Концентрация аммиака
Концентрация аммиака в сыворотке крови в норме 11—35 мкмоль/л. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония — NH4+, количество неионизированного NH3 невелико (~ 1%).
Токсичность аммиака
Механизм токсического действия аммиака: Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую… α-Кетоглутарат + НАДH2 + NH3 → глу + НАД+. Уменьшение концентрации α-кетоглутарата вызывает: угнетение реакции трансаминирования АК и снижение …Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как…Обмен глутамина
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы… Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный…Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.
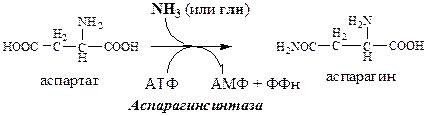
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
Обмен аланина
В кишечнике: Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из…ОРНИТИНОВЫЙ ЦИКЛ
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт. Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота,…Реакции орнитинового цикла
(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и… 1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется…Регенерация аспартата из фумарата
Малат может направиться в митохондрии и включиться в ЦТК. Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.Энергетический баланс орнитинового цикла
· при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ; · в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2,… Орнитиновый цикл в печени выполняет 2 функции:Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут.
ГИПЕРАММОНИЕМИЯ
Причинами гипераммониемии могут быть: 1. генетические дефекты ферментов орнитинового цикла в печени; 2. вторичное поражение печени в результате цирроза, гепатита или других заболеваний.Наследственные нарушения орнитинового цикла и их основные проявления
При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости… Тяжесть течения заболевания зависит также от степени снижения активности… Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л),…Обмен аминокислот и аммиака между тканями
Печень
В печень азот поступает в основном в виде аммиака, глутамина, аланина, а меньше в виде других АК в основном из мышц и кишечника. Поглощает АК с разветвленной цепью (вал, лей, иле). Синтезирует глюкозу в основном из аланина и серина.
Мышцы
Поглощают АК с разветвленной цепью (вал, лей, иле). Выделяют много аланина и глутамина меньше других АК.
Кишечник
Поглощает глутамин. Выделяет много аланина. С пищей из кишечника поступают все аминокислоты.
Мозг
Поглощает много АК с разветвленной цепью (вал, лей, иле). Выделяет много глутамина.
Почки
Поглощают глутамин. Выделяют много серина и немного аланина.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы).Серотонин
Серотонин образуется из три в надпочечниках, ЦНС и тучных клетках.
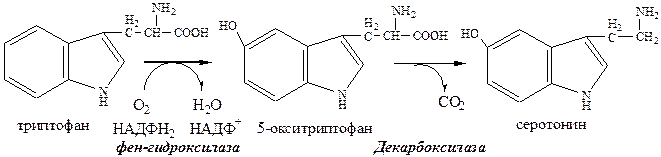 Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
ГАМК
ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию.
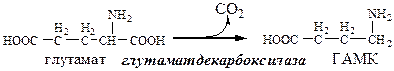
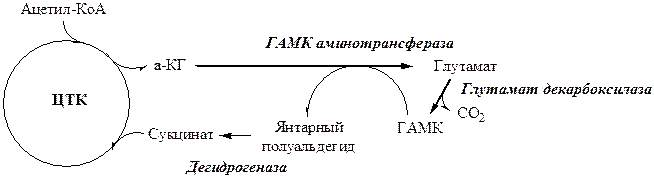
ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.
Гистамин
Гистамин – медиатор воспаления, аллергических реакций, пищеварительный… 1. стимулирует секрецию желудочного сока, слюны;Дофамин
Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников.
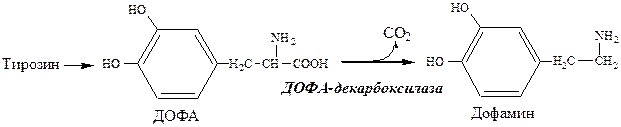
Дофамин – нейромедиатор среднего отдела мозга.
ЛЕКЦИЯ № 19
Тема: Белки III. Специфические пути обмена аминокислот
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
ФОЛИЕВАЯ КИСЛОТА
Фолиевая кислота широко распространёна в продуктах животного и растительного происхождения, синтезируется микрофлорой кишечника. Активная форма фолиевой кислоты – ТГФК. Она образуется в печени при восстановлении фолиевой кислоты с участием…Образование одноуглеродных фрагментов, их взаимопревращения
В составе ТГФК одноуглеродные фрагменты могут подвергаться взаимопревращениям: метиленовая группа превращаться в метенильную (-СН=), формильную… Затем ТГФК отдает одноуглеродные фрагменты на:Недостаточность фолиевой кислоты
Гиповитаминоз фолиевой кислоты приводит к: 1. мегалобластической (макроцитарной) анемии. Она характеризуется уменьшением… 2. лейкопении;ОБМЕН СЕРИНА И ГЛИЦИНА
Синтез серина: Обмен глицина:Путь образования оксалатов из глицина
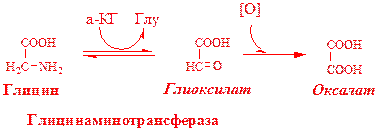
Схема путей обмена серина и глицина
Серии и глицин выполняют в организме человека разнообразные и очень важные функции.
Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга.
Наследственные нарушения обмена глицина
Гиперглицинемия возникает при дефекте глицинрасщепляющей системы. Проявляется повреждением мозга, судорогами, гипотонией, нарушением дыхания. Глицинурия характеризуется повышенным выделением глицина с мочой (до 1 г/сут)… Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления…МЕТИОНИН
Метионин — незаменимая аминокислота, может регенерировать из гомоцистеина с участием серина и глицина. Метионин:
1. участвует в синтезе белков организма;
2. является источником метильной группы, используемой в реакциях трансметилирования;
3. является источником атома серы, необходимого для синтеза цистеина;
4. участвует в реакциях дезаминирования;
5. Метионил-тРНК участвует в инициации процесса трансляции.
Образование S-аденозилметионина
Метильная группа в метионине прочно связана с серой, поэтому донором этого одноуглеродного фрагмента служит активная форма метионина - S-аденозилметионин (SAM). (SAM — нестабилен т.к. сера при валентности 2 имеет 3 связи). SAM образуется при присоединении метионина к аденозину с участием метионинаденозилтрансферазы (есть во всех типах клеток). Аденозин образуется при гидролизе АТФ.
Ресинтез метионина, роль ТГФК и витамина В12.
Связь обменов метионина и цистеина
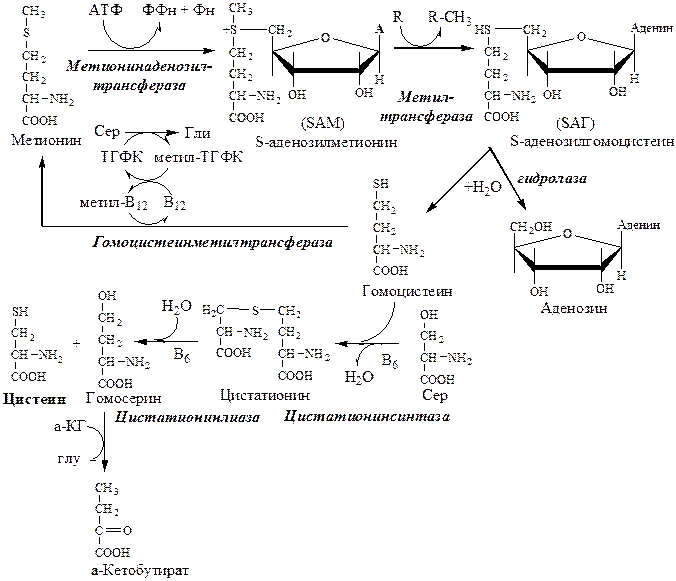 Реакции трансметилирования с участием S-аденозилметионина
Реакции трансметилирования с участием S-аденозилметионина
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
Синтез холина
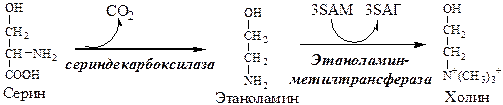
Синтез лецитина
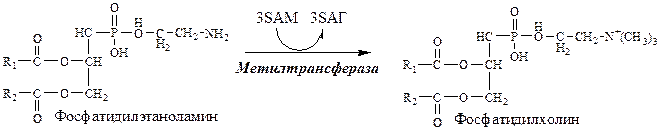
Аналогично синтезируются:
1. из ГАМК → карнитин;
2. из гуанидинацетата → креатин;
3. из норадреналина → адреналин;
4. из карнозина → анзерин;
5. Реакции трансметилирования используются также в синтезе азотистых оснований, инактивации гормонов, нейромедиаторов и обезвреживании ксенобиотиков.
ЦИСТЕИН
Нарушение синтеза цистеина возникает при гиповитаминозе фолиевой кислоты, В6, В12 или наследственных дефектах цистатионинсинтазы и цистатионинлиазы.… Обмен цистеина: схема путей, их значение. Цистеин:Образование сульфат-иона, его утилизация (образование ФАФС).
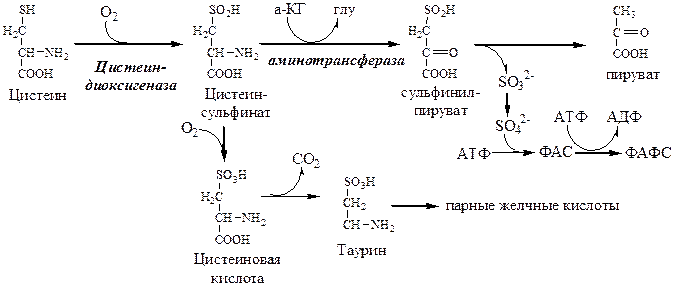 ФАФС используется:
ФАФС используется:
1. В обезвреживании ксенобиотиков:
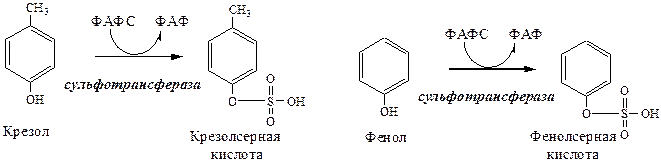
2. В синтезе гликозаминогликанов (сульфирование ОН групп производных глюкозы, галактозы сульфотрансферазой).
ФЕНИЛАЛАНИН
Фенилкетонурия
Классическая ФКУ — наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы (частота 1:10000 новорождённых), которые… При ФКУ концентрация фен повышается в крови в 20—30 раз, в моче — в 100—300… Проявления ФКУ:Обмен тирозина в надпочечниках и нервной ткани
Тирозингидроксилаза (тирозинмонооксигеназа) Fe2+ -зависимый фермент, в… Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин — гормон широкого…Болезнь Паркинсона
Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма используют…Обмен тирозина в меланоцитах
Меланины присутствуют в сетчатке глаз, в составе волос, в коже. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов…Альбинизм
При наследственном дефекте тирозиназы (1:20000) в меланоцитах нарушается синтез меланинов и развивается альбинизм.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи, сетчатки глаз и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи.
Превращение тирозина в щитовидной железе
В щитовидной железе из тирозина синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин.
Катаболизм тирозина в печени
Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза.… Алкаптонурия(«чёрная моча»)Тирозинемии
1. Тирозинемия типа 1 (тирозиноз). Причиной заболевания является дефект фумарилацетоацетатгидролазы. Накапливающиеся метаболиты снижают активность… 2. Тирозинемия типа II (синдром Рихнера—Ханхорта). Причина — дефект… 3. Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента…ТРИПТОФАН
Триптофан – незаменимая АК. В физиологических условиях >95% триптофана метаболизирует по кинурениновому пути и 1% по серотониновому пути.
Схема кинуренинового пути
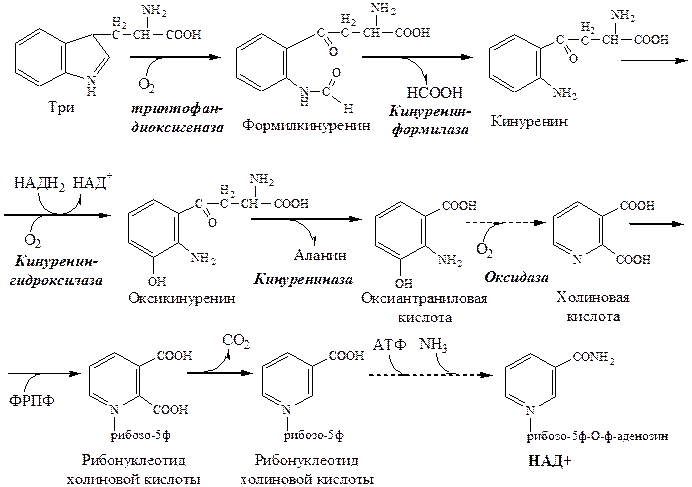 Синтез НАД+ уменьшает потребность организма в витамине РР.
Синтез НАД+ уменьшает потребность организма в витамине РР.
Серотониновый путь
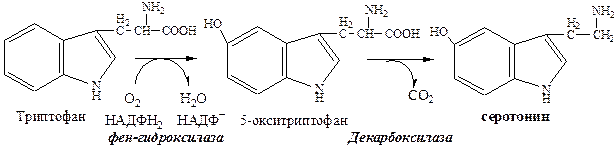 Серотонин образуется в надпочечниках, ЦНС и тучных клетках.
Серотонин образуется в надпочечниках, ЦНС и тучных клетках.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Образование и использование в организме ГАМК и ГОМК. Антиоксидантные, антигипоксические и адаптогенные свойства Глу, Асп, их клиническое применение.
ГЛУТАМАТ
Синтез глутамата
Глутамат образуется:
1). при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой:
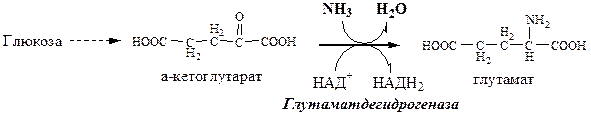
2). В реакция переаминирования с участием аминотрансфераз:
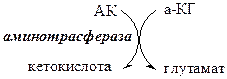
Использование глутамата
2. Ведущая роль в интеграции азотистого обмена. Обеспечивает реакции переаминирования АК: глутамат универсальный донор аминогруппы для синтеза… 3. Является источником α-КГ, необходимого для ЦТК и синтеза АТФ; 4. Входит в состав глутатиона;ГЛУТАМИН
Синтез глутамина
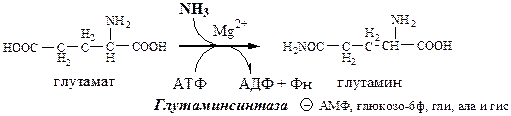
Использование глутамина
1. Используется в синтезе белков, углеводов;
2. Источник азота в синтезе пуриновых и пиримидиновых оснований, аспарагина, аминосахаров;
3. Обеспечивает транспорт азота из тканей;
АСПАРТАТ
Синтез аспартата
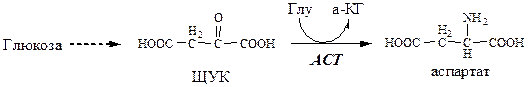
Использование аспартата
1. Используется в синтезе белков, липидов, углеводов;
2. Участвует в орнитиновом цикле при синтезе мочевины;
3. Участвует в синтезе карнозина, анзерина, пуриновых и пиримидиновых нуклеотидов, N-ацетиласпарагиновой кислоты.
АСПАРАГИН
Синтез аспарагина
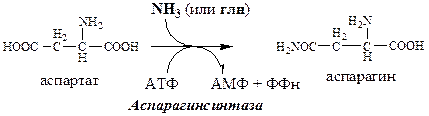
Использование аспарагина
1. Используется в синтезе белков, липидов, углеводов;