рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Многоэлектронного атома
Реферат Курсовая Конспект
Многоэлектронного атома
Многоэлектронного атома - раздел Энергетика, Валентным электроном Каждый Электрон В Атоме Обладает Орбитальным Моментом Импульса ...
Каждый электрон в атоме обладает орбитальным моментом импульса  и собственным (спиновым) моментом импульса
и собственным (спиновым) моментом импульса  . Механические моменты связаны с соответствующими магнитными моментами, вследствие чего между всеми
. Механические моменты связаны с соответствующими магнитными моментами, вследствие чего между всеми  и
и  имеется взаимодействие. Моменты
имеется взаимодействие. Моменты  и
и  складываются в результирующий (полный) механический момент атома
складываются в результирующий (полный) механический момент атома  . При этом возможны два случая:
. При этом возможны два случая:
1. Моменты  взаимодействуют между собой сильнее, чем с
взаимодействуют между собой сильнее, чем с  , которые в свою очередь сильнее связаны друг с другом, чем с
, которые в свою очередь сильнее связаны друг с другом, чем с  . Вследствие этого моменты
. Вследствие этого моменты  складываются в результирующий
складываются в результирующий  , а моменты
, а моменты  в результирующий
в результирующий  , затем уже
, затем уже  и
и  дают суммарный момент атома
дают суммарный момент атома  . Такой вид связи называется связью Рессель - Саундерса или LS – связью и встречается чаще всего.
. Такой вид связи называется связью Рессель - Саундерса или LS – связью и встречается чаще всего.
2. Каждая пара  и
и  взаимодействует между собой сильнее, чем с другими
взаимодействует между собой сильнее, чем с другими  и
и  , вследствие этого образуется результирующий момент импульса
, вследствие этого образуется результирующий момент импульса  для каждого электрона, которые затем объединяются в
для каждого электрона, которые затем объединяются в  атома. Такой вид связи, называемый jj – связью, наблюдается у тяжелых атомов.
атома. Такой вид связи, называемый jj – связью, наблюдается у тяжелых атомов.
Рассмотрим связь Рессель - Саундерса. Орбитальные квантовые числа  i всегда бывают целыми. Тогда квантовое число L суммарного орбитального момента также будет целым (или нулем).
i всегда бывают целыми. Тогда квантовое число L суммарного орбитального момента также будет целым (или нулем).
Квантовое число S результирующего спинового момента атома  может быть целым (при четном числе электронов в атоме
может быть целым (при четном числе электронов в атоме  ), либо нецелым (при нечетном). Например, при
), либо нецелым (при нечетном). Например, при  = 4 S может принимать значения 2 (все
= 4 S может принимать значения 2 (все  параллельны друг другу) и 0 (все
параллельны друг другу) и 0 (все  антипараллельны).
антипараллельны).
Квантовое число 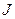 результирующего момента
результирующего момента  может иметь одно из следующих значений:
может иметь одно из следующих значений: 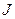 = L + S; L + S – 1; …; L – S .
= L + S; L + S – 1; …; L – S . 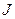 будет целым, если S – целое (т.е. при четном числе электронов в атоме).
будет целым, если S – целое (т.е. при четном числе электронов в атоме).
Энергия атома зависит от взаимной ориентации моментов  (т.е. от квантового числа L), от взаимной ориентации моментов
(т.е. от квантового числа L), от взаимной ориентации моментов  (от квантового числа S), а также от взаимной ориентации моментов
(от квантового числа S), а также от взаимной ориентации моментов  и
и  (от квантового числа J).
(от квантового числа J).
Терм атома записывается следующим образом:  , где S – результирующее спиновое квантовое число, L – результирующее орбитальное квантовое число,
, где S – результирующее спиновое квантовое число, L – результирующее орбитальное квантовое число,  ,
, 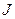 – результирующее квантовое число. Например:
– результирующее квантовое число. Например: 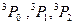 . Эти термы имеют L = 1, S = 1 и отличаются квантовым числом
. Эти термы имеют L = 1, S = 1 и отличаются квантовым числом 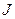 .
.
Символ  содержит в себе сведения о значениях трех квантовых чисел L, S,
содержит в себе сведения о значениях трех квантовых чисел L, S, 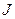 . Если S < L, то число 2S + 1 даст мультиплетность терма, т.е. количество подуровней, отличающихся значением числа
. Если S < L, то число 2S + 1 даст мультиплетность терма, т.е. количество подуровней, отличающихся значением числа 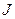 . Если S >L, мультиплетность равна 2L + 1.
. Если S >L, мультиплетность равна 2L + 1.
– Конец работы –
Эта тема принадлежит разделу:
Валентным электроном
Линейчатые спектры атомов с одним... валентным электроном... Атомы щелочных металлов имеют один внешний электрон и заполненные внутренние оболочки Этот внешний электрон движется...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Многоэлектронного атома
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов