рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- ЗАПОЛНЕНИЕ ЗОН ЭЛЕКТРОНАМИ. МЕТАЛЛЫ, ДИЭЛЕКТРИКИ, ПОЛУПРОВОДНИКИ
Реферат Курсовая Конспект
ЗАПОЛНЕНИЕ ЗОН ЭЛЕКТРОНАМИ. МЕТАЛЛЫ, ДИЭЛЕКТРИКИ, ПОЛУПРОВОДНИКИ
ЗАПОЛНЕНИЕ ЗОН ЭЛЕКТРОНАМИ. МЕТАЛЛЫ, ДИЭЛЕКТРИКИ, ПОЛУПРОВОДНИКИ - раздел Энергетика, Зонная теория твердого тела Каждая Разрешенная Зона Содержит Конечное Число (N) Энергетичес...
Каждая разрешенная зона содержит конечное число (N) энергетических уровней. В соответствии с принципом Паули на каждом уровне может находиться лишь два электрона с противоположно направленными спинами. При ограниченном числе электронов, содержащихся в кристалле, заполненными окажутся лишь несколько наиболее низких энергетических зон. Все остальные зоны будут пусты.
Рассмотрим различные варианты заполнения зон электронами.
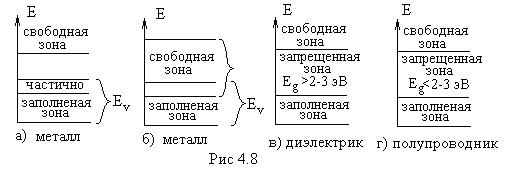 1. Предположим, что последняя зона, в которой есть электроны, заполнена частично. Поскольку эта зона заполняется валентными электронами атомов, ее называют валентной. Под действием внешнего электрического поля электроны, занимающие уровни вблизи границы заполнения, начнут ускоряться и переходить на более высокие свободные уровни той же зоны. В кристалле потечет ток. Таким образом, кристаллы с частично заполненной валентной зоной хорошо проводят электрический ток, т. е. являются металлами.
1. Предположим, что последняя зона, в которой есть электроны, заполнена частично. Поскольку эта зона заполняется валентными электронами атомов, ее называют валентной. Под действием внешнего электрического поля электроны, занимающие уровни вблизи границы заполнения, начнут ускоряться и переходить на более высокие свободные уровни той же зоны. В кристалле потечет ток. Таким образом, кристаллы с частично заполненной валентной зоной хорошо проводят электрический ток, т. е. являются металлами.
Рассмотрим в качестве примера натрий. Каждый атом натрия содержит 11 электронов, распределенных по состояниям следующим образом: 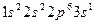 . При объединении атомов в кристалл энергетические уровни атомов превращаются в зоны. Электроны внутренних оболочек атома полностью заполняют зоны, образованные из уровней 1s, 2s и 2р, так как в них на 2N, 2N и 6N состояний приходятся соответственно 2N, 2N и 6N электронов. Валентная зона образована из 3s состояний. В ней имеется всего 2N состояний, на которые приходится N электронов (по одному валентному электрону на атом). Таким образом, в кристаллическом натрии валентная зона заполнена только наполовину. Естественно, что все сказанное относится к температуре 0 К. Аналогичным образом заполняются зоны и у других щелочных элементов.
. При объединении атомов в кристалл энергетические уровни атомов превращаются в зоны. Электроны внутренних оболочек атома полностью заполняют зоны, образованные из уровней 1s, 2s и 2р, так как в них на 2N, 2N и 6N состояний приходятся соответственно 2N, 2N и 6N электронов. Валентная зона образована из 3s состояний. В ней имеется всего 2N состояний, на которые приходится N электронов (по одному валентному электрону на атом). Таким образом, в кристаллическом натрии валентная зона заполнена только наполовину. Естественно, что все сказанное относится к температуре 0 К. Аналогичным образом заполняются зоны и у других щелочных элементов.
2. Допустим, что валентная зона заполнена электронами полностью, но она перекрывается со следующей разрешенной зоной, незанятой электронами. Если к такому кристаллу приложить внешнее электрическое поле, то электроны начнут переходить на уровни свободной зоны и возникнет ток. Данный кристалл также является металлом. Типичный пример металла с указанной зонной структурой - магний. У каждого атома Mg (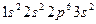 ) в валентной оболочке имеется два электрона. В кристаллическом магнии валентные электроны полностью заполняют 3s-зону. Однако эта зона перекрывается со следующей разрешенной зоной, образованной из Зр-уровней.
) в валентной оболочке имеется два электрона. В кристаллическом магнии валентные электроны полностью заполняют 3s-зону. Однако эта зона перекрывается со следующей разрешенной зоной, образованной из Зр-уровней.
3.Рассмотрим теперь случай, когда валентная зона заполнена электронами полностью и отделена от следующей за ней свободной зоны широкой (больше 2—3 эВ) запрещенной зоной (энергетической щелью). В кристалле с такой зонной структурой внешнее поле не может создать электрического тока, так как электроны в заполненной зоне не могут изменить своей энергии. Следовательно, вещество представляет собой диэлектрик. Типичным диэлектриком является ионный кристалл NaCl. Положительно заряженные ионы натрия имеют электронную конфигурацию Na (
(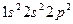 ),а отрицательные ионы хлора - Cl
),а отрицательные ионы хлора - Cl (
(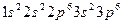 ). Зоны, образующиеся из полностью заполненных атомных уровней тоже оказываются полностью заполненными. Последней заполненной зоной является зона Зр С1
). Зоны, образующиеся из полностью заполненных атомных уровней тоже оказываются полностью заполненными. Последней заполненной зоной является зона Зр С1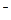 , а следующей за ней свободной зоной — зона 3s Na+. Энергетическая щель между этими зонами составляет около 9 эВ.
, а следующей за ней свободной зоной — зона 3s Na+. Энергетическая щель между этими зонами составляет около 9 эВ.
Если ширина запрещенной зоны меньше 2—3 эВ, то кристалл называют полупроводником. В полупроводниках за счет тепловой энергии k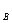 T заметное число электронов оказывается переброшенным в свободную зону, называемую зоной проводимости. При очень низких температурах любой полупроводник становится хорошим диэлектриком.
T заметное число электронов оказывается переброшенным в свободную зону, называемую зоной проводимости. При очень низких температурах любой полупроводник становится хорошим диэлектриком.
Таким образом, между металлами и диэлектриками существует качественное различие, а между диэлектриками и полупроводниками — только количественное.
Заполнение зон электронами в металлах, диэлектриках и полупроводниках схематически показано на рис. 4.8. В табл.1 приведены значения ширины запрещенной зоны для некоторых диэлектриков и полупроводников.
Таблица1. Ширина запрещенной зоны
| Кристалл | Eg, эВ |
| C (алмаз) BN Al2O5 Si Ge GaAs InSb Sn (серое) | 5,2 4,6 7,0 1,11 0,66 1,43 0,17 0,08 |
Электронная структура атомов, образующих твердое тело, не единственный фактор, обусловливающий различие в заполнении зон. На примере NaCl мы видели, что важную роль играет природа химической связи. Характер заполнения энергетических зон зависит также и от структуры кристалла. Так, например, углерод в структуре алмаза — диэлектрик, а углерод в структуре графита обладает металлическими свойствами.
– Конец работы –
Эта тема принадлежит разделу:
Зонная теория твердого тела
Зонная теория твердого тела... Уравнение Шредингера для твердого тела... Любое твердое тело состоит из атомов т е представляет собой совокупность ядер и электронов В кристаллических...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ЗАПОЛНЕНИЕ ЗОН ЭЛЕКТРОНАМИ. МЕТАЛЛЫ, ДИЭЛЕКТРИКИ, ПОЛУПРОВОДНИКИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов