Изотермы Ван-дер-Ваальса - раздел Приборостроение, Приборостроения и информатики Для Фиксированных Значений Р И Т Уравнение (2) Есть Уравнение Т...
Для фиксированных значений Р и Т уравнение (2) есть уравнение третьей степени относительно объема газа V и, следовательно, оно может иметь либо три вещественных корня (V1, V2, V3), либо один вещественных корень (V1) и два комплексно-сопряженных корня (комплексно-сопряженные корни отбрасываем). Поэтому на диаграмме PV (см.рис.2) прямая, параллельная оси V может пересекать изотерму ВдВ либо в трех точках В, D, F, либо в одной K или L. Построение по точкам изотерм ВдВ для трех характерных температур приводит к кривым, изображенным на рис.2. Сначала проведем анализ нижней изотермы ABCDEFG.
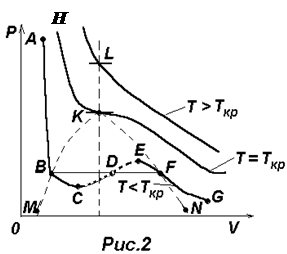 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Ветви ВС и EF изображают метастабильные состояния вещества (т.е. относительно устойчивые состояния): перегретую жидкость и пересыщенный пар и могут быть осуществлены при определенных условиях. Участок СДЕ ни при каких условиях осуществлен быть не может.
 С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
При Т>ТКР газ никаким сжатием нельзя перевести в жидкость.
Возвращаясь к анализу изотерм ВдВ, изображенных на рис.2, делаем заключение, что область, ограниченная сверху изотермой НК и справа линией КВМсоответствует жидкой фазе. Область, ограниченная сверху кривой МВКFN, соответствует жидкой и газообразной фазе (жидкость + пар) и область, расположенная правее линии НКFN, соответствует газообразной фазе.
При Т>>ТКР и относительно малых давлениях реальные газы ведут себя как идеальные газы.
Внутренняя энергия моля реального газа
U=CVТ –a/V, (4)
т.е. меньше энергии идеального газа U=CVТ. Для произвольной массы реального газа
U=n(CVТ –a/V). (5)
Все темы данного раздела:
Основные положения молекулярно-кинетической теории
Согласно молекулярно-кинетическим представлениям любое тело состоит из атомов и молекул. Эти частицы находятся в беспорядочном, хаотическом движении, интенсивность которого зависит от температур
Уравнение состояния идеального газа
Простейшим объектом, для которого может быть получено уравнение состояния, является идеальный газ.
Идеальным называется газ, молекулы которого имеют пренебрежимо малый собственный объем
Следовательно, уравнение состояния для моля идеального газа имеет вид
РV=RT. (4)
Для произвольной массы m газа можно переписать уравнение (4) в виде
РV=(m/M)RT или РV=nRT, (5)
где n=m/M - число молей. Очевидно, ч
Основное уравнение молекулярно-кинетической теории идеального газа
Пусть в сосуде в виде куба со стороной l находится N молекул. Рассмотрим движение одной из молекул. Пусть молекула движется из центра куба в одном из 6 возможных направлений (рис.1) , наприм
Барометрическая формула. Распределение Больцмана
При выводе уравнения (14) предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы газа находятся в поле тяготения Земли,
Закон Максвелла о распределении молекул идеального газа по скоростям
В газе, находящемся в состоянии равновесия, установится некоторое стационарное (не меняющееся со временем) распределение молекул по скоростям, которое подчиняется вполне определенному стати
Распределение Максвелла-Больцмана
В 1866 г. Больцман (1844-1906 г.) вывел более общее распределение, включающее распределение Максвелла, которое называется распределением Максвелла-Больцмана
Среднее число столкновений и средняя длина свободного пробега молекул
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом.
Между двумя последовательными столкновениями молекулы проходят некоторое расстояни
Лекция 3. Явления переноса
До сих пор мы рассматривали исключительно равновесные системы, характеризующиеся при постоянных внешних условиях неизменностью параметров (Р, V, T, ) во времени и отсутствием в системе поток
Диффузия
Это перенос массы из мест с большей плотностью
Теплопроводность
Это перенос теплоты (внутренней энергии) от более нагретых мест к менее нагретым. Фурье (1822 г.) установил, что количество теплоты
Внутреннее трение (вязкость)
Оно возникает между слоями жидкости или газа, движущимися упорядоченно с различными скоростями u. Из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате
Лекция 4,5. Физические основы термодинамики
Термодинамика, как и молекулярная физика, занимается изучением физических процессов, происходящих в макроскопических системах, т.е. в телах, содержащих огромное число микрочастиц, взаимодействующих
Термодинамические системы. Равновесные состояния и равновесные процессы
Будем называть термодинамической системой любое макроскопическое тело, находящееся в равновесном или близком к равновесному состоянию.
Состояния любой термодинамической системы могут быть
Внутренняя энергия идеального газа. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
Важной характеристикой термодинамической системы является ее внутренняя энергия U – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.
Работа и теплота
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия закрытой системы (т.е. системы, которая не обменива
Первое начало термодинамики (ПНТ)
Допустим, что некоторая термодинамическая система (например, газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q
Работа газа при изменении его объема
Теплоемкость
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
Изохорический процесс
Для него V=const. Диаграмма этого процесса (изохора) изображе
Изобарический процесс
Для него P=const. Диаграмма этого процесса (изобара) изображе
Изотермический процесс
Для него Т-const. Например, процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ происходят при постоянной температуре, если внешнее давление постоянно.
Адиабатический процесс
Это процесс, при котором отсутствует теплообмен () между системой и окружающей средой. К адиабатическ
Круговые процессы (циклы)
Процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние называется круговым процессом или циклом. На диаграмме процессов цикл изображается замкнутой криво
Цикл Карно
В 1824 г. французский физик и инженер Н. Карно (1796-1832) опубликовал единственную работу, в которой теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и д
Энтропия
4.10.1. Энтропия в термодинамике
При изучении ПНТ () отмечалось , что dU является пол
Второе начало термодинамики (ВНТ)
Выражая всеобщий закон сохранения и превращения энергии, первое начало термодинамики (ПНТ) не позволяет определить направление протекания процессов. Действительно, процесс самопроизвольной передачи
Силы и потенциальная энергия межмолекулярных взаимодействий
В лекциях 1-2 изучались идеальные газы, молекулы которых имеют пренебрежимо малый собственный объем и не взаимодействуют друг с другом на расстоянии. Свойства реальных газов при высоких давлениях и
Уравнение Ван-дер-Ваальса (ВдВ)
В научной литературе существуют более 150 отличающихся друг от друга уравнений состояния реального газа. Среди них нет ни одного действительно верного и универсального.
Остановимся на урав
Фазы и фазовые переходы
Фазой называется совокупность частей системы одинаковых по всем физическим, химическим свойствам и структурному составу. Например, существует твердая, жидкая и газообразная фазы (называемые
Фазовые диаграммы. Тройная точка
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь друг с другом. Такое равновесие наблюдается лишь в ограниченном интервале температур, причем каждому значению темпе
Кристаллическая решетка. Виды связей между частицами решетки
Основной особенностью кристаллов, отличающих их от жидкостей и аморфных твердых тел, является периодичность пространственного расположения частиц (атомов, молекул или ионов), из которых состоит кри
Элементы квантовой статистики
Дуализм (двойственность) волн и частиц относится к числу фундаментальных концепций современной физики. В кристаллах имеется много полей, которые проявляют оба эти аспекта - и волновой, и корпускуля
Фермионы и бозоны. Распределение Ферми-Дирака и Бозе-Эйнштейна
Согласно современной квантовой теории все элементарные и сложные частицы, а также квазичастицы разделяются на два класса - фермионы и бозоны.
К фермионам относятся электроны, прото
Понятие о вырождении системы частиц
Система частиц называется вырожденной, если её свойства за счёт квантовых эффектов отличаются от свойств классических систем. Найдём критерии вырождения частиц. Распределения Ферми-Дирака и Бозе-Эй
Понятие о квантовой теории электропроводности металлов
Согласно квантовой теории электрон в металле не имеет точной траектории, его можно представить волновым пакетом с групповой скоростью, равной скорости электрона. Квантовая теория учитывает движение
Элементы зонной теории кристаллов
В прошлом семестре рассматривались энергетические уровни электрона в атоме водорода [см. конспект лекций, ч. III, формула (11. 14)]. Там было показано, что значения энергии, которые может и
Деление кристаллов на диэлектрики, металлы и полупроводники
Все кристаллы разделяются на диэлектрики, металлы и полупроводники. Рассмотр
Собственная проводимость полупроводников
Электропроводность химически чистого полупроводника (например, чистого Ge или чистого Si
Примесные полупроводники
9.6.1. Донорная примесь, полупроводники n-типа
Введение в полупроводник примесей сильно влияет на его электрические свойства. Рассмотрим, например, что произойдет, если в решетке ге
P-n-переход
Во многих областях современной электроники большую роль играет контакт двух полупроводников с n- и p- типам
Строение атомных ядер
Ядро – центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный заряд. Размер атома составляет единицы ангстрем (1А=10-10м), а ядра ~ 10
Дефект массы и энергия связи ядра
При образовании ядра происходит уменьшение его массы: масса ядра Мя меньше, чем сумма масс составляющих его нуклонов на Dm – дефект массы ядра:
Dm=Zmp
Ядерные силы и их свойства
В состав ядра кроме нейтронов входят положительно заряженные протоны и они должны бы отталкиваться друг от друга, т.е. ядро атома должно бы разрушиться, но это не происходит. Оказывается, на малых
Радиоактивность
Радиоактивность есть самопроизвольное изменение состава ядра, происходящее за время, существенно большее характерного ядерного времени (10-22с). Условились считать, что изм
Закон радиоактивного распада
Радиоактивный распад – явление статистическое, поэтому все предсказания носят вероятностный характер. Самопроизвольный распад большого числа ядер атомов подчиняется закону радиоактивного распада
Ядерные реакции
Ядерными реакциями называют процессы превращения атомных ядер, вызванные их взаимодействием друг с другом или с элементарными частицами.
Как правило, в ядерных реакциях участвуют два ядра
Лекция 12. Элементарные частицы и современная физическая картина мира
При введении понятия элементарных частиц первоначально предполагалось, что есть первичные, далее неделимые частицы, из которых состоит вся материя. Таковыми вплоть до начала 20 века с
Взаимопревращаемость частиц
Характерной особенностью элементарных частиц является их способность к взаимным превращениям. Всего вместе с античастицами открыто более 350 элементарных частиц, и число их продолжает расти. Больши
Античастицы
В микромире каждой частице соответствует античастица.
Например первая античастица – позитрон (антиэлектрон) была обнаружена в 1935 г., его заряд равен +е. В вакууме позитрон столь ж
 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости. С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).






Новости и инфо для студентов