рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Биотехнологии
- /
- Метод електронного балансу
Реферат Курсовая Конспект
Метод електронного балансу
Метод електронного балансу - раздел Биотехнологии, ОКИСНО-ВІДНОВНІ РЕАКЦІЇ При Складанні Рівнянь Цим Методом Необхідно Дотримуватись Так...
При складанні рівнянь цим методом необхідно дотримуватись такої послідовності:
1) написати схему хімічної реакції;
2) визначити ступінь окиснення елементів та виявити ті елементи, які його змінюють в ході реакції;
3) виписати елементи, які змінили ступінь окиснення, вказавши їх заряди до та після реакції. Записати переміщення електронів у вигляді напівреакції:
- процес віддавання електронів і, як наслідок, підвищення ступеню окиснення елементу, має назву окиснення;
- процес прийняття електронів і , як наслідок, зниження ступеню окиснення елементу - відновлення;
4) відповідно закону збереження маси та енергії необхідно зрівняти кількість відданих та прийнятих електронів наступним чином:
- знайти найменше спільне кратне для кількостей переміщених електронів в напівреакціях відновлення та окиснення; далі , поділивши найменше спільне кратне на число прийнятих електронів в процесі відновлення, одержуємо коефіцієнт для окислювача та його відновленої форми, а, поділивши найменше спільне кратне на число відданих електронів, одержуємо коефіцієнт для відновника та його окисленої форми (ставляться коефіцієнти за вертикальною рискою). Ці коефіцієнти використовуються в рівнянні реакції;
5) зрівнювання кількості атомів елементів, які не змінили ступінь окиснення, виконують звичайним методом відповідно закону збереження маси;
6) правильність розстановки коефіцієнтів необхідно обов’язково перевірити за одним (або двома) хімічними елементами, які не змінювали ступінь окиснення. Як правило, це оксиген або гідроген. Наприклад, схема реакції:
H2S + K2Cr2O7 + H2SO4 —> S + Cr2(SO4)3 + K2SO4 + H2О Визначимо ступені окиснення елементів і виявимо ті елементи , які його змінили:
+1 –2 +1 +6 -2 0 +3
H2S + K2Cr2O7 +H2SO4 —> S + Cr2(SO4)3 + K2SO4 + H2O
Випишемо ці елементи та напишемо напівреакції:

| - процес окиснення | ||
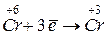
| - процес відновлення |
Коефіцієнти 3 та 2 поставимо в рівняння реакції відповідно в лівій та в правій його частині:
3H2S + K2Cr2O7 + H2SO4 _____> 3S + Cr2(SO4)3 + K2SO4 + H2O
Кількість атомів калію в лівій та правій частинах рівняння однакова. Підрахувавши кількість іонів SO42- (3+1 = 4 ) , ставимо перед сульфатною кислотою коефіцієнт 4. Підраховуємо кількість атомів гідрогену в лівій частині:
3*2 + 4*2 = 14, тоді перед молекулою води в правій частині рівняння треба поставити коефіцієнт 7, щоб в правій частині рівняння теж було 14 атомів гідрогену. Завершене рівняння буде мати вигляд:
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
Речовину, в якій хімічний елемент окиснювався, віддаючи електрони, називають відновником.Речовину, в якій хімічний елемент відновлювався, приймаючи електрони, називають окиснювачем.
У вищенаведеному рівнянні реакції окиснювачем є K2Cr2O7, а відновником – H2S.
Якщо окиснювач та відновник різні речовини, то такі окисно-відновні реакції називаються міжмолекулярними. Реакції, в яких хімічні елементи, що змінюють ступені окиснення, входять до складу однієї молекули, називаються внтурішньомолекулярними. Окисно-відновні реакції називають реакціями диспропорціонування, якщо один і той же елемент, маючи до початку реакції проміжний ступінь окиснення, буде окиснюватися до більш високого і відновлюватись до більш низького ступеня окиснення, тобто частина молекул речовини буде окиснювачем, а друга частина молекул – відновником.
Наприклад: +1 +5 –2 +1 –1 0
а) 2 КС1О3 = 2 КС1 + 3 О2

| - процес відновлення | ||

| - процес окиснення |
+5 -2
Тут окиснювач С1 та відновник О входять до складу однієї речовини КС1О3.
Це внутрішньомолекулярна окисно-відновна реакція.
+6 +7 +4
б) К2MnO4 + CH3COOH _____> KMnO4 + MnO2 + CH3COOK + H2O
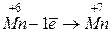
| - процес окиснення | |

| - процес відновлення |
Підставляючи коефіцієнти в рівняння реакції, одержуємо:
3K2MnO4 + 4CH3COOH = 2KMnO4 + MnO2 + 4CH3COOK + 2H2O
Тут 2 моль K2MnO4 є відновник , 1 моль K2MnO4 – окиснювач. Це реакція диспропорціонування.
– Конец работы –
Эта тема принадлежит разделу:
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІІ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Метод електронного балансу
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов