рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Производство
- /
- Материальный баланс трубчатой печи
Реферат Курсовая Конспект
Материальный баланс трубчатой печи
Материальный баланс трубчатой печи - раздел Производство, Отделение конверсии природного газа в производстве аммиака Состав Природного Газа: Сн4-90,90%; С...
Состав природного газа:
СН4-90,90%; С2Н6-4,5% С3Н8-1,5% С4Н10-0,1% С5H12-0,3% N2-2,5%
СО2-0,2%
Сводная таблица составов природного и продувочного газов подоваемых на смешение
| Вещество | Природный газ, нм3/ч; | Продувочный газ, нм3/ч; | Технологический газ , нм3/ч; | Об.% |
| СН4 | 30542,4 | 31476,4 | 77,15 | |
| С2Н6 | - | 3,71 | ||
| С3Н8 | - | 1,24 | ||
| С4Н10 | 33,6 | - | 33,6 | 0,08 |
| С5H12 | 100,8 | - | 100,8 | 0,25 |
| N2 | 5,63 | |||
| Ar | - | 0,934 | ||
| H2 | - | 10,85 | ||
| СО2 | 67,2 | - | 67,2 | 0,165 |
| Всего |
Исходные данные:
нагрузка по сухому газу 40800 нм3/ч;
состав сухого газа (об. %): СН4 90,90;
С2Н6 4,5;
С3Н8 1,5;
С4Н10 0,1;
С5H12 0,3
N2 2,5;
отношение пар:газ 3,3;
давление 4 МПа;
температура газа на входе 515 °С;
температура газа на выходе 860 °С;
концентрация метана на выходе 8,9 об.%
Расчет равновесия ведем для следующих реакций:
СН4 + Н2О = СО + 3Н2
СО + Н2О = СО2 + Н2
Принимаем, что все высшие гомологи метана конвертируются до СН4. Реакция конверсии монооксида углерода идет до равновесия.
Уравнения нормального сродства:

Кр =5,2МПа2
Рассчитаем константу равновесия реакции конверсии оксида углерода:

Кр2 = 0,86
Расчет материального баланса ведем на 1000 нм3 сухого газа.
Введем обозначения неизвестных компонентов:
Х1 – количество CO на выходе, кмоль;
Х2 – количество СО2 на выходе, кмоль;
Х3 – количество водорода на выходе, кмоль;
Х4 – количество прореагировавшей воды, кмоль;
Х5 – количество CH4, кмоль.
С учетом принятых обозначений составляем балансовые уравнения по элементам, входящим в состав реагирующих веществ, общий баланс и условие равновесия:
условие равновесия по первому маршруту

|
условие равновесия по второму маршруту
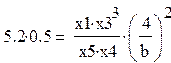
0,5-ст. прибижение к равновесию (при 0,5 лучшее соответствие с промышленной кончентрацией метана на выходе ≈10%)
b=X1+X2+X3+X4+X5+nN2+nAr
баланс по углероду
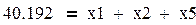
|
баланс по водороду

баланс по кислороду

|
Решая систему уравнений, получаем
Х1 = 14,27 кмоль/т.нм3;
Х2 = 13,38 кмоль/т.нм3;
Х3 = 97,56 кмоль/т.нм3;
Х4 = 106,43кмоль/т.нм3;
Х5 = 12,54 кмоль/т.нм3.
Результаты расчета сводим в таблицу 3.1.
Таблица 3.1
Материальный баланс трубчатой печи на 1000 нм3 сухого газа
| Компо- | Приход | Расход | ||||
| нент | кмоль | кг | % | кмоль | кг | % |
| Сухой газ, в т.ч. СН4 С2Н6 С3Н8 С4Н10 С5H12 N2 H2 СО СО2 Ar | 34,44 1,656 0,554 0,036 0,112 2,513 4,843 - 0,074 0,417 | 551,04 49,68 24,38 2,09 8,06 70,36 9,69 - 3,55 16,67 | 77,15 3,71 1,24 0,08 0,25 5,63 10,85 - 0,17 0,93 | 12,54 - - - - 2,51 97,56 14,26 13,38 0,42 | 200,69 - - - - 70,36 195,12 399,42 588,90 16,67 | 8,9 - - - - 1,78 69,35 10,14 9,51 0,3 |
| Водяной пар | 147,31 | 2651,58 | 106,43 | 1915,72 | ||
| Итого | 191,95 | 3386,83 | 247,1 | 3386,83 |
Расчет материального баланса горения
Таблица 3.2
Сводная таблица материального баланса горения на 1000нм3 природного газа
| ПРИХОД | РАСХОД | |||||
| вещество | кмоль | кг | вещество | кмоль | Кг | |
| CH4 C2H6 C3H8 C4H10 C5H12 CO2 N2 | 40,58 2,01 0,67 0,05 0,13 0,09 1,12 | 649,28 60,3 29,48 2,9 9,36 3,96 31,36 | CO2 N2 O2 H2O | 50,93 418,47 14,48 100,89 | 2240,92 11717,86 260,64 1816,02 | |
| ВСЕГО | 584,7 | 16034,74 | ||||
| Воздух в т.ч. O2 N2 H2O | 100,89 417,35 9,99 | 3237,44 11685,8 17,982 | ||||
| ВСЕГО | 534,7 | 16089,7 |
no2=2nCH4+3,5nC2H6+5nC3H8+6,5nC4H10+8nC5H12+no2дг
где: ni-концентрация i-го компонента.
no2=2*40,58+3,5*2,01+5*0,67+6,5*0,05+8*0,13+ no2дг=92,91 +no2дг
аналогично считаем и другие компаненты системы.
3.3.2 Тепловые расчеты
 | ||||||
 | ||||||
 | ||||||
| ||||||
|
Общее уравнение теплового баланса:
Q1 + Qx + Qтп = Q2
где: Q1- теплосодержание входного потока, кДж/1000нм3;
Q2- теплосодержание выходного потока, кДж/1000нм3;
Qx- тепловыделение за счет химической реакции, кДж/1000нм3;
Qт.п.- теплоподвод к реакционной трубе, кДж/1000нм3.
Расчитаем тепло входного потока:
Q1= tº ∑ Cpi niн ,
где: tº-начальная температура, (515 ºС);
ni-количество i-го компонента перед входом в колонну, кмоль;
Срi-средняя теплоемкость i-го вещества (Дж/(моль*К)).
Таблица 3.3
Средняя теплоёмкость веществ и соединений
| вещество | Cр кДж /моль (t=788K) | Cр кДж /моль (t=1133K) |
| С2H6 | 82,57 | 96.00 |
| СО2 | 45,56 | 47.84 |
| Н2 | 29,27 | 29.72 |
| СН4 | 49,56 | 56.99 |
| N2 | 30,21 | 30.84 |
| СО | 30,47 | 31.14 |
| Н2О | 36,02 | 37,59 |
| Ar | 20,79 | 20.79 |
| C5H12 | 192,6 | 221.6 |
| C4H10 | 155,9 | 179.9 |
| C3H8 | 118,8 | 137.9 |
Q1=515*((34,44*49,56)+(1,656*82,57)+(0,55*118,8)+(0,036*155,9)+
(0,112*192,6)+(0,074*45,56)+(2,513*30,21)+(0,417*20,79)+(4,843*29,27)+
(147,313*36,02))=3848337,5кДж/моль*К
Расчитаем тепло выходного потока:
Q2= tк ∑Cpi niк ,
где: tк-конечная температура (860ºС)
Q2=860*((56,99*12,543)+(47,84*13,384)+(30,84*2,513)+(20,79*0,417)+
(29,72*97,558)+(37,59*106,429)+(31,14*14,265))=7555607,4 кДж/моль*К
Тепло химической реакции:
Qx=∑ΔHrjΔn ,
где: Нrj-энтальпия j-го вещества, КДж/моль
Таблица 3.4
Изменения стандартной энтальпии
| вещество | ΔНf , 298 КДж/моль |
| СО2 СО Н2О H2 Ar N2 C5H12 C4H10 C3H8 С2H6 СН4 | - 393,51 - 110,5 - 241,84 -146,4 -124,7 -103,9 -84,67 -74,85 |
Qx=-74,85*103*21,87+(-84,67*103*1,656)+(-103,9*103*0,554)+
(-124,7*103*0,036)+(-146,4*103*0,112)+(-393,51*103*(-13,31))+
(-241,84*103*40,884)+(-110,5*103*14,625) = - 8123481,53 кДж/моль*К
Qт.п. + Q1 + Qx = Q2
- Qт.п. = Q1 + Qx - Q2
- Qт.п. = 3848337,5-8123481,53-7555607,4
Qт.п = 11830751,43 кДж/моль*К
Таблица 3.5
– Конец работы –
Эта тема принадлежит разделу:
Отделение конверсии природного газа в производстве аммиака
На сайте allrefs.net читайте: "Отделение конверсии природного газа в производстве аммиака"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Материальный баланс трубчатой печи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов