рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
Реферат Курсовая Конспект
Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі - раздел Философия, МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ» Слово “Атом” У Перекладі З Грецької Мови Означає “Неподільний”. За Сучасними ...
Слово “атом” у перекладі з грецької мови означає “неподільний”. За сучасними уявленнями атом — електронейтральна мікросистема, що складається з позитивно зарядженого ядра та негативно заряджених електронів. Ядра атомів складаються з двох типів мікрочастинок (нуклонів) — протонів 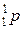 і нейтронів
і нейтронів 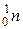 , основні характеристики яких подано в табл. 3.1.
, основні характеристики яких подано в табл. 3.1.
Основна маса атома зосереджена в ядрі і характеризується масовим числом А, яке дорівнює сумі чисел протонів (тобто заряду ядра) Z і нейтронів N:
A = Z + N
Таблиця 3.1.
Основні характеристики елементарних частинок, які входять до складу атома
| Частинка | Символ | Маса спокою | Заряд | ||
| абсолютна, кг | а.о.м. | електричний, Кл | відносний | ||
| Протон | 
| 1,673·10-27 | 1,007276 | 1,602·10-19 | +1 |
| Нейтрон | 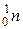
| 1,675·10-27 | 1,008665 | ||
| Електрон | 
| 9,109·10-31 | 0,000549 | 1,602·10-19 | -1 |
Атом і ядро характеризуються такими лінійними розмірами: атома — ~ 10-10, ядра — ~ 10-14 – 10-15 м. Заряд ядра, як головна характеристика атома, визначає число електронів, що обертаються навколо нього.
Отже, заряд ядра зумовлює належність атома до певного виду хімічних елементів і відповідає порядковому номеру елемента в періодичній системі елементів Д. І. Менделєєва. У позначенні елемента відображають масове число А і кількість протонів Z, наприклад 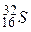 ,
, 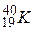 .
.
Атоми з однаковими значеннями Z, але з різними значеннями А і N, наприклад  ,
,  ,
, 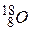 , називають ізотопами.
, називають ізотопами.
Атоми з однаковими значеннями N, але з різними значеннями Z і А, наприклад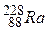 ,
, і
і 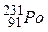 , називають ізотонами;з однаковими значеннями А, але різними Z і N, наприклад
, називають ізотонами;з однаковими значеннями А, але різними Z і N, наприклад 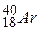 ,
, 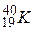 ,
,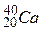 — ізобарами.
— ізобарами.
За сучасними уявленнями рух електронів в атомі описується законами квантової механіки, в основі якої лежать уявлення про квантування енергії, хвильово-корпускулярну (двоїсту) природу електрона, хвильовий характер його руху. Енергія є найважливішою характеристикою електрона. Вона може приймати лише визначені дискретні значення, поглинається і випромінюється лише порціями – квантами.
Отже, електрон прийнято розглядати одночасно і як мікроматеріальну частинку (див. табл. 1.1), і як хвилю. Математично це положення описується рівнянням де Бройля (1924), відповідно до якого частинці, що має масу і рухається зі швидкістю v, відповідає хвиля довжини λ:
λ=h/mv,
де h — стала Планка (h = 6,626·10-34Дж • с).
Із поняття подвійної природи електрона випливає важливий висновок, відомий під назвою принципу невизначеності Гейзенберга: мікрочастинка (електрон), так само як і електронна хвиля, не має одночасно точних значень координат та імпульсу (mv). Цей принцип виявляється в тому, що чим точніше визначаються координати частинки, тим більш невизначеним стає її імпульс (або пов'язана з ним швидкість частинки v), і навпаки. Тому для описування руху мікрочастинки користуються імовірнісним підходом, коли визначають не її точне положення, а ймовірність знаходження її в тій чи іншій ділянці навколоядерного простору. Наприклад, якщо для вимірювання координати електрона користуватися розсіюванням світлових квантів — фотонів (тобто «освітлювати» електрон), то похибка такого вимірювання дорівнюватиме довжині хвилі світла: Δx ~ λ. Причому, чим менше значення λ, тим вища точність вимірювання. Проте зі зменшенням довжини хвилі λ, світла одночасно зростає імпульс фотона p=2nh/λ, який частково передаватиметься електрону під час зіткнення з ним кванта світла.
Отже, в числове значення імпульсу електрона вноситься неконтрольована величина — змінна Δрх, яка має порядок імпульсу фотона. Величини Δх, Δрх та інші однойменні компоненти пов'язані такими співвідношеннями:
Δx·Δpx ≥ h; Δy·Δpy≥h; Δz·Δpz≥h,
які називають співвідношеннями невизначеності Гейзенберга. Тому умови, сприятливі для точного вимірювання координати електрона (мала довжина хвилі), виявляються несумісними з умовами, необхідними для точного вимірювання його імпульсу (мале значення енергії кванта світла), і навпаки. Така ситуація є результатом того, що електрон з огляду на свою подвійну природу не допускає одночасної локалізації в координатному та імпульсному просторі. Звідси випливає, що рух електрона не можна описати за допомогою поняття про траєкторію.
З огляду на хвильову природу електрон характеризується хвильовою функцією ψ, яка є амплітудою тривимірної електронної хвилі, тобто це амплітуда ймовірності перебування електрона у певній ділянці простору.
Ймовірність знаходження електрона в об'ємі атомного простору dV (об'ємі, що знаходиться між двома сферами з радіусами r i(r + dr), і розраховується як добуток 4πr2dr) визначають величиною ψ2dV, або ψ24πr2dr. Ця величина дає наочне уявлення про розподіл електронної густини в атомі, тобто про функцію радіального розподілу.
Густина ймовірності, або електронна густина, — квадрат абсолютної величини хвильової функції |ψ|2, розрахований для певного моменту часу та певної точки простору. Ця величина пропорційна ймовірності виявлення електрона у цій точці в зазначений час.
Електронна хмара, або атомна електронна орбіталь (АО), — квантово-механічна модель стану (руху) електрона в атомі — ділянка навколоядерного простору атома, що обмежена умовною поверхнею, яка не має чітких меж і де густина ймовірності наявності електрона (тобто електронна густина) досягає наперед заданої величини (як правило, 90 %).
Розрахунок хвильової функції ψ, тобто повне описування руху електрона в будь-якому тривимірному полі U{x, yf z), у квантовій механіці здійснюють за допомогою рівняння Шредінгера (1926):
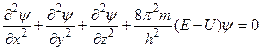
де h — стала Планка; т — маса електрона; U, Е — відповідно потенційна і повна енергія електрона.
Розв'язування рівняння Шредінгера, отже, математичне описування електронної орбіталі (АО) можливе лише за умови цілком визначених дискретних значень певних характеристик електрона, які називають квантовими числами: головним (п), орбітальним (l), магнітним (тl) і спіновим (ms).
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... кафедра хімії... МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни ХІМІЯ ЗМІСТ МОДУЛЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов