Вывод давления идеального газа из молекулярно-кинетических представлений
Вывод давления идеального газа из молекулярно-кинетических представлений.
2. Уравнение состояния ИГ. Изопроцессы. При обычных условиях (т.е. при комнатной температуре и атмосферном давлении) параметры состояния таких газов, как…Согласно закону равнораспределения среднее значение энергии одной молекулы <e> будет (при той же температуре) тем больше, чем сложнее молекула, чем больше у нее степеней свободы. При определении <e> нужно учесть, что колебательная степень свободы должна обладать вдвое большей энергетической емкостью по сравнению с поступательной или вращательной. Поэтому на каждую колебательную степень свободы должны приходиться в среднем две половинки kT — одна в виде кинетической энергии и одна в виде потенциальной. Таким образом, средняя энергия молекулы должна равняться , где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i=nпост + nвращ + 2nколеб.
N0-кол-во атомов в молекуле.
Число степеней свободы=3N0
Делятся на
1)поступательные n=3
2)вращательные n=3
3)колебательные n=3N0-6
Лин.молекула: nвращ=2
nколебат=3N0-5
4. Число степеней свободы многоатомной молекулы. Энергия многоатомной молекулы идеального газа.
Числом степеней свободы механической системы называется число независимых величин, с помощью которых может быть задано положение системы.
В физике выделяют три “вида” степеней свободы:
1) поступательная
2) вращательная
3)колебательная
Закон равнораспределения гласит о том, что на каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия, равная (1/2)kT.
Твердое тело имеет 6 степеней свободы (3 вращательные и 3 поступательные см. рис. выше), точка имеет 3 степени свободы (поступательные).
Рассмотрим молекулу состоящую из N атомов. В этом случае количество степеней свободы равняется 3N (положение каждой из N точек – атомов должно быть задано тремя координатами).
| 3N | |||
| поступательные | вращательные | колебательные | |
| n=3 | N=3 | n=3N-6 | |
| n=2 (линейная молекула) | n=3N-5 (линейная молекула) | ||
Среднее значение энергии одной молекулы <e> будет (при той же температуре) тем больше, чем сложнее молекула, чем больше у нее степеней свободы. При определении <e> нужно учесть, что колебательная степень свободы должна обладать вдвое большей энергетической емкостью по сравнению с поступательной и вращательной. Это объясняется тем, что поступа тельное и вращательное движение молекулы связано с наличием только кинетической энергии, в то время как колебательное движение связано с наличием и кинетической, и потенциальной энергии, причем для гармонического осциллятора среднее значение кинетической и потенциальной энергии оказывается одинаковым т.е. в среднем две половинки kT.
Таким образом <e>=(i/2)kT, где i=nпост+nвр+2nколеб
Молекулы идеального газа не взаимодействуют между собой. Поэтому внутреннюю энергию одного моля идеального газа можно найти, умножив постоянную Авогадро на среднюю энергию одной молекулы:

5. Внутренняя энергия газа. Работа.
6. Количество теплоты. Первое начало термодинамики.
При совершении одним телом работы А над другим, равно как и при сообщении одним телом другому теплоты Q, эти тела обмениваются внутренней энергией — энергия одного из тел увеличивается, а энергия другого на столько же уменьшается. Это следует из закона сохранения энергии. В термодинамике этот закон принято называть первым началом и записывать следующим образом: Q=U2—U1+A (1.5). Здесь U1 и U2 - начальное и коночное значения внутренней энергии тела (или системы тел), А - работа, совершенная телом (или системой), Q — количество сообщенной телу (системе) теплоты. Словами первое начало термодинамики формулирует! следующим образом: количество теплоты, сообщенное системе, идет на приращение внутренней энергии системы и па совершение системой работы над внешними телами.Подчеркнем, что речь идет о разности конечного и начального значений внутренней энергии.
При вычислении совершенной системой работы или полученной системой теплоты обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому (в пределе — бесконечно малому) изменению параметров системы. Уравнение (1,5) для элементарного процесса имеет вид D¢Q=DU+D¢A ,где D¢Q элементарное количество теплоты, D¢A — элементарная работа и DU — приращение внутренней энергии системы в ходе данного элементарного процесса. Весьма важно иметь в виду, что D¢Q и D¢A нельзя рассматривав как приращения величии Q и А. Соответствующее элементарному процессу D какой-либо величины f можно рассматривать как приращение этой величины только в том случае, если åDf, соответствующая переходу из одного состояния в другое, не зависит от пути, по которому совершается переход, т.е. если величина f является функцией состояния. В отношении функции состояния можно говорить о ее «запасе» в каждом из состояний. Например, можно говорить о запасе внутренней энергии, которым обладает система в различных состояниях.
7. Теплоемкость идеального газа при постоянном объеме
Теплоемкостью какого-либо тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин. Аналитически это определение записывается следующим образом:  Если нагревание производится при постоянном объеме, то тело не совершает работы над внешними телами и, cледователь- но, вся теплота идет на приращение внутренней энергии тела: d¢QV=dU. Отсюда следует, что молярная теплоемкость любого вещества при постоянном объеме равна
Если нагревание производится при постоянном объеме, то тело не совершает работы над внешними телами и, cледователь- но, вся теплота идет на приращение внутренней энергии тела: d¢QV=dU. Отсюда следует, что молярная теплоемкость любого вещества при постоянном объеме равна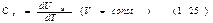 В термодинамике подобные формулы принято записывать в виде
В термодинамике подобные формулы принято записывать в виде  Символ частной производной, снабженный индексом V, указывает на то, что при дифференцировании функции UM по переменной Т объем предполагается постоянным.
Символ частной производной, снабженный индексом V, указывает на то, что при дифференцировании функции UM по переменной Т объем предполагается постоянным.
8. Теплоемкость идеального газа при постоянном давлении.
Теплоемкость при постоянном давлении Ср бывает больше, чем CV, потому что при p=const нагреваемое тело расширяется и часть подводимой теплоты расходуется на совершение работы над внешними телами.
Внутренняя энергия определяется с точностью до произвольной аддитивной постоянной. Поэтому константу в выражении для UM можно отбросить. В результате получается формула  Внутренняя энергия — величина аддитивная. Следовательно, внутренняя энергий массы газа m будет равна
Внутренняя энергия — величина аддитивная. Следовательно, внутренняя энергий массы газа m будет равна  Напишем уравнение d¢Q=dU + pdV для моля газа, предположив, что теплота сообщается газу при постоянном давлении: d¢QP=dUM + pdVM Разделив это выражение на приращение температуры dT, которое получает газ при сообщении ему теплоты d¢QP, придем к формуле для молярной теплоемкости газа при постоянном давлении:
Напишем уравнение d¢Q=dU + pdV для моля газа, предположив, что теплота сообщается газу при постоянном давлении: d¢QP=dUM + pdVM Разделив это выражение на приращение температуры dT, которое получает газ при сообщении ему теплоты d¢QP, придем к формуле для молярной теплоемкости газа при постоянном давлении: 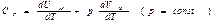 Согласно формуле (1.25) слагаемое dUM/dT равно молярной теплоемкости при постоянном объеме. Учтя это и использовав применяемый в термодинамике способ записи формул, придём к соотношению
Согласно формуле (1.25) слагаемое dUM/dT равно молярной теплоемкости при постоянном объеме. Учтя это и использовав применяемый в термодинамике способ записи формул, придём к соотношению 
9. Уравнение адиабаты идеального газа.
Процесс, протекающий без теплообмена с внешней средой, называется адиабатическим. Чтобы найти уравнение адиабаты идеального газа, т. е. уравнение, связывающее параметры состояния идеального газа при адиабатическом процессе, воспользуемся уравнением первого начала термодинамики, подставив в него выражение 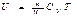 дляU:
дляU: 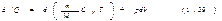 В отсутствие теплообмена с внешней средой d¢Q = 0. Поэтому для адиабатического процесса уравнение (1.39) упрощается следующим образом:
В отсутствие теплообмена с внешней средой d¢Q = 0. Поэтому для адиабатического процесса уравнение (1.39) упрощается следующим образом: (мы произвели очевидные преобразования). Взяв дифференциал от обеих частей уравнения pV=(m/M)RT, придем к равенству
(мы произвели очевидные преобразования). Взяв дифференциал от обеих частей уравнения pV=(m/M)RT, придем к равенству
Умножим уравнение (1.40) на отношение R/CV и сложим его с уравнением (1.41). В результате получим g pdV+Vdp=0 (1.42), где g=1+R/CV=CP/CV. Наконец, разделим (1.42) на произведение pV:  Левую часть этого уравнения можно представить в виде d ln(pV g). откуда следует, что pVg=const. Мы получили уравнение адиабаты идеального газа в переменных р и V. Его называют уравнением Пуассона. Представив уравнение (1.44) в виде pV×Vg-1=const и учтя, что произведение рV пропорционально T, придем к уравнению адиабаты идеального газа в переменных T и V: TVg-1=const (1.45) (константы в формулах (1.44) и (1.45) имеют, разумеется, неодинаковое значение).
Левую часть этого уравнения можно представить в виде d ln(pV g). откуда следует, что pVg=const. Мы получили уравнение адиабаты идеального газа в переменных р и V. Его называют уравнением Пуассона. Представив уравнение (1.44) в виде pV×Vg-1=const и учтя, что произведение рV пропорционально T, придем к уравнению адиабаты идеального газа в переменных T и V: TVg-1=const (1.45) (константы в формулах (1.44) и (1.45) имеют, разумеется, неодинаковое значение).
10. Работа, совершаемая газом при различных процессах.
Если известна для некоторого обратимого процесса зависимость давления газа от объема, т.е. функция p=f(V) работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования: Здесь V1 и V2 — объем газа в начальном и конечном состояниях. Чтобы произвести интегрирование, нужно выразить р через V. Для этого воспользуемся связью междур и V при различных процессах.
Здесь V1 и V2 — объем газа в начальном и конечном состояниях. Чтобы произвести интегрирование, нужно выразить р через V. Для этого воспользуемся связью междур и V при различных процессах.
Уравнение политропы идеального газа pVn=const можно написать следующим образом: pV n=p1V1n=p2V2n, где р1V1 и р2,V2 — значения давления и объема газа соответственно в первом (начальном) и втором (конечном) состояниях, р и V — давление и объем в любом промежуточном состоянии. Выразим в соответствии с этим соотношением давление газа через его объем и значения параметров в начальном состоянии: p=p1V1n/Vn
Подстановка этого выражении в (1.54) дает:  Рассмотрим сначала случай n¹1: тогда интеграл в (1.55) равен
Рассмотрим сначала случай n¹1: тогда интеграл в (1.55) равен 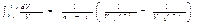 Подставив это значение интеграла в (1.55) и произведя несложные преобразования, получим
Подставив это значение интеграла в (1.55) и произведя несложные преобразования, получим 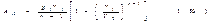 Полученное выражение можно преобразовать, воспользовавшись тем, что, какой бы процесс ни происходил с идеальным газом, его параметры связаны уравнением состояния. В частности, это справедливо и для начального состояния: p1V1=(m/M)RT1 (1.57). Приняв во внимание (1.57), напишем выражение (1.56) в виде
Полученное выражение можно преобразовать, воспользовавшись тем, что, какой бы процесс ни происходил с идеальным газом, его параметры связаны уравнением состояния. В частности, это справедливо и для начального состояния: p1V1=(m/M)RT1 (1.57). Приняв во внимание (1.57), напишем выражение (1.56) в виде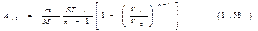
Выражения (1.56) и (1.58) дают работу, совершаемую идеальным газом при любом политропическом процессе, кроме изотермического (соответствующего n=1). В частности, при адиабатическом процессе 
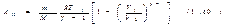 Чтобы вычислить работу идеального газа при изотермическом процессе, заменим давление в формуле (1.54) его выражением через другие величины в соответствии с уравнением состояния. В результате получим (Т можно вынести за знак интеграла, поскольку она постоянна)
Чтобы вычислить работу идеального газа при изотермическом процессе, заменим давление в формуле (1.54) его выражением через другие величины в соответствии с уравнением состояния. В результате получим (Т можно вынести за знак интеграла, поскольку она постоянна) 
Итак, работа, совершаемая идеальным газом при изотермическом процессе, равна 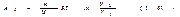 При изобарическом процессе работа, совершаемая любым телом, в том числе и идеальным газом, равна, как следует из (1.54), A12=p(V2—V1) (1.62). Тот же результат получается, если положить в (1.56) n равным нулю. В заключение отметим, что при изохорическом процессе работа равна нулю, что справедливо для любых тел.
При изобарическом процессе работа, совершаемая любым телом, в том числе и идеальным газом, равна, как следует из (1.54), A12=p(V2—V1) (1.62). Тот же результат получается, если положить в (1.56) n равным нулю. В заключение отметим, что при изохорическом процессе работа равна нулю, что справедливо для любых тел.
11. Вероятность. Функция распределения и ее свойства.
Т. к. dwv=f(v)dv=φ(vx)dvxφ(vy)dvyφ(vz)dvz →  ,
,
где φ(vx) – функция распределения по vx. Вероятности того, что молекула имеет проекции скорости в интервалах (vx, vx+dvx), (vy, vy+dvy), (vz, vz+dvz), являются независимыми, поэтому в соответствии с теоремой об умножении вероятностей независимых событий можно записать:
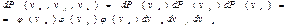
Отсюда получаем, что f(v)=φ(vx)φ(vy)φ(vz).
Откуда 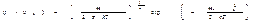 . Функция нормирована на единицу. Т.е.
. Функция нормирована на единицу. Т.е. 
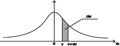
График зависимости φ(vx) от vx
12. Функция распределения Максвелла для вектора скорости в декартовых координатах.
Т.к.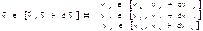 ,то
,то

Для выяснения способа, которым можно количественно описать распределение молекул по значениям скорости, воспользуемся следующим приёмом. Возьмем в “воображаемом” пространстве, которое мы будем называть v-пространством (пространством скорости), прямоугольные координатные оси, по которым станем откладывать значения vx, vy и vz отдельных молекул (имеются в виду компоненты по осям x, y и z, взятым в обычном пространстве). Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве. Из-за столкновений положения точек будут непрерывно меняться, но их плотность в каждом месте будет оставаться неизменной (т.к. рассматривается равновесное состояние газа). Вследствии равновесности всех движений расположение точек относительно начала координат будет сферически симметричным, следовательно, плотность точек v-пространстве может зависить только от модуля скорости v. Отсюда получаем:


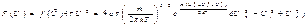
13. Функция распределения Максвелла для модуля скорости.
Найдем dw или относительное число молекул, модуль скорости которых заключен в интервале [v, v+dv]. Таким молекулам соответствуют все точки попадающие в шаровой слой с радиусами v и v+dv (рис. 1). Объем этого слоя равен V=4πv2dv. Объемная плотность вероятности во всех точках слоя одинакова, поэтому по теореме о сложении вероятностей, вероятность попадания в этот слой:
DP=f(v)·4πv2dv.
F(v)=dP/dv=4πv2f(v)→ F(v)= Это и есть закон распределения Максвелла по модулю скорости. Функция…Энтропией (статистическое определение) называется величина S = k*lnΩ. Энтропия – мера беспорядка, т.е состояниям с большим беспорядком соответствует большая вероятность. Величина возрастания энтропии в замкнутой макросистеме может служить мерой необратимости процессов, протекающих в системе. В предельном случае, когда процессы обратимы, то энтропия не изменяется. Свойства энтропии
1. Энтропия – аддитивная функция состояния, т.е. S = S1 + S2, энтропия полного цикла равна нулю.
2. Энтропия замкнутой системы не убывает: 

 3. Теорема Нернста
3. Теорема Нернста
21. Коэффициент полезного действия (к.п.д.) тепловой машины.
Коэффицие́нт поле́зного де́йствия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой; обозначается обычно η (« эта»). η = Wпол/Wcyм. КПД является безразмерной величиной и часто измеряется в процентах. Математически определение КПД может быть записано в виде:
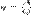 x 100 %, где А — полезная работа, а Q — затраченная работа. В силу закона сохранения энергии КПД всегда меньше единицы или равен ей, то есть невозможно получить полезной работы больше, чем затрачено энергии. КПД теплово́го дви́гателя — отношение совершённой полезной работы двигателя, к энергии, полученной от нагревателя. КПД теплового двигателя может быть вычислен по следующей формуле
x 100 %, где А — полезная работа, а Q — затраченная работа. В силу закона сохранения энергии КПД всегда меньше единицы или равен ей, то есть невозможно получить полезной работы больше, чем затрачено энергии. КПД теплово́го дви́гателя — отношение совершённой полезной работы двигателя, к энергии, полученной от нагревателя. КПД теплового двигателя может быть вычислен по следующей формуле
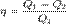 ,где Q1 — количество теплоты, полученное от нагревателя, Q2 — количество теплоты, отданное холодильнику. Наибольшим КПД обладают тепловые двигатели, работающие по циклу Карно.
,где Q1 — количество теплоты, полученное от нагревателя, Q2 — количество теплоты, отданное холодильнику. Наибольшим КПД обладают тепловые двигатели, работающие по циклу Карно.
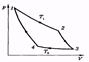
22. Цикл Карно. КПД цикла Карно. Теоремы Карно.
Рассмотренный Карно тепловой двигатель состоял из нагревателя с температурой Тi, холодильника с Т2 и рабочего тела, т.е. устройства, способного получать тепло и совершать работу. Под рабочим телом пока будем понимать идеальный газ в цилиндре с поршнем. Карно рассмотрел цикл из двух изотерм и двух адиабат. При изотермическом расширении 1-2 газ находится в контакте с нагревателем (T1). Пусть при этом газ получает тепло Q1. На изотерме 3-4 газ отдает тепло Q2 холодильнику (T2). КПД двигателя: 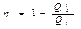
Данный цикл является обратимым (если его проводить бесконечно медленно). Он может быть проведен в обратном направлении, и при этом газ совершает отрицательную работу, нагреватель получает обратно тепло Q1; холодильник отдает газу тепло Q2, которое он получил в прямом цикле. Именно так в принципе работает любой бытовой холодильник.
Дальнейшие рассуждения проще всего провести, изобразив цикл Карно не на диаграмме р, V, а на диаграмме S, Т (энтропия — температура). На этой диаграмме цикл Карно имеет вид прямоугольника (рис. 3.6). Изотермы изображаются прямыми 1-2 и 3-4, адиабаты — прямыми 2-3 и 4-1. Согласно (3.3) полученное тепло Qi = T'i(S2 - Si) и равно площади под 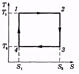 отрезком 1-2.
отрезком 1-2.
23. Закон Кулона.
Модуль силы взаимодействия двух точечных зарядов в вакууме прямо пропорционален произведению модулей этих зарядов и обратно пропорционален квадрату расстояния между ними.
Важно отметить, что для того, чтобы закон был верен, необходимы:
1. точечность зарядов — то есть расстояние между заряженными телами много больше их размеров — впрочем, можно доказать, что сила взаимодействия двух объёмно распределённых зарядов со сферически симметричными непересекающимися пространственными распределениями равна силе взаимодействия двух эквивалентных точечных зарядов, размещённых в центрах сферической симметрии;
2. их неподвижность. Иначе вступают в силу дополнительные эффекты: магнитное поле движущегося заряда и соответствующая ему дополнительная сила Лоренца, действующая на другой движущийся заряд;
3. взаимодействие в вакууме.
В векторном виде в формулировке Ш. Кулона закон записывается следующим образом:
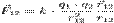 где
где 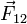 — сила, с которой заряд 1 действует на заряд 2; q1,q2 — величина зарядов;
— сила, с которой заряд 1 действует на заряд 2; q1,q2 — величина зарядов; 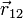 — радиус-вектор (вектор, направленный от заряда 1 к заряду 2, и равный, по модулю, расстоянию между зарядами — r12); k — коэффициент пропорциональности. Таким образом, закон указывает, что одноимённые заряды отталкиваются (а разноимённые — притягиваются).
— радиус-вектор (вектор, направленный от заряда 1 к заряду 2, и равный, по модулю, расстоянию между зарядами — r12); k — коэффициент пропорциональности. Таким образом, закон указывает, что одноимённые заряды отталкиваются (а разноимённые — притягиваются).
В СИ 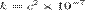 = 8,9875517873681764×109 (Кг·м3)/(Кл2·c2) (или Ф−1·м) и записывается следующим образом:
= 8,9875517873681764×109 (Кг·м3)/(Кл2·c2) (или Ф−1·м) и записывается следующим образом: 
24. Напряженность электрического поля. Электрические силовые линии. Принцип суперпозиции полей.
Напряжённость электри́ческого по́ля — векторная физическая величина, характеризующая электрическое поле в данной точке и численно равна отношению силы  действующей на пробный заряд, помещенный в данную точку поля, к величине этого заряда q:
действующей на пробный заряд, помещенный в данную точку поля, к величине этого заряда q:  . Также иногда называется силовой характеристикой электрического поля. Математически зависимость вектора
. Также иногда называется силовой характеристикой электрического поля. Математически зависимость вектора 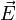 от координат пространства сама задаёт векторное поле. Модуль напряжённости электрического поля в СИ измеряется в В/м (Вольт на метр). Для системы СИ Используя потенциалы
от координат пространства сама задаёт векторное поле. Модуль напряжённости электрического поля в СИ измеряется в В/м (Вольт на метр). Для системы СИ Используя потенциалы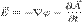 К примеру, для точечного заряда, исходя из закона Кулона
К примеру, для точечного заряда, исходя из закона Кулона  Так как эквипотенциальные поверхности являются в этом случае сферами, то производная по нормали есть производная по радиусу. Таким образом мы можем прийти к так называемому кулоновскому полю:
Так как эквипотенциальные поверхности являются в этом случае сферами, то производная по нормали есть производная по радиусу. Таким образом мы можем прийти к так называемому кулоновскому полю:  . В силу центральной симметрии поля точечного заряда:
. В силу центральной симметрии поля точечного заряда: 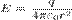 .
.
Электрическое поле наглядно изображается с помощью силовых линий. Силовой линией электрического поля называется линия, в каждой точке которой касательная совпадает с вектором напряженности поля. Силовые линии проводятся с такой густотой, чтобы число линий, пронизывающих воображаемую площадку 1м2, перпендикулярную полю, равнялось величине напряженности поля в данном месте. Тогда по изображению электрического поля можно судить не только о направлении, но и о величине напряженности поля. Электрическое поле называется однородным, если во всех его точках напряженность Е одинакова. В противном случае поле называется неоднородным. При положительном заряде, образующем поле, вектор напряженности направлен вдоль радиуса от заряда, при отрицательном - вдоль радиуса по направлению к заряду. Исходя из положительного заряда (или входя в отрицательный заряд) силовые линии теоретически простираются до бесконечности. 
Напряженность электрического поля, создаваемого системой зарядов в данной точке пространства, равна векторной сумме напряженностей электрических полей, создаваемых в той же точке зарядами в отдельности:

Это свойство электрического поля означает, что поле подчиняется принципу суперпозиции.
В случае двух электрических полей с напряженностями Е1 и Е2 модуль вектора напряженности равен:
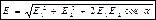
, (17)
где a — угол между векторами E1 и E2.
25. Работа сил электростатического поля.
Работа перемещения заряда.На положительный точечный заряд q в электрическом поле с напряжённостью E действует сила
F = q E. При перемещении заряда на отрезке dl силами поля совершается работа dA = Fdl =q E dl cos (E, dl). При перемещении заряда q силами электрического поля на произвольном конечном отрезке из точки 1 в точку 2 эта работа равна . Рассмотрим перемещение точечного заряда q в поле точечного заряда Q, напряженность поля которого
. Рассмотрим перемещение точечного заряда q в поле точечного заряда Q, напряженность поля которого  . Проекция отрезка dl на направление вектора E (рис. 1.5) есть dr = dl cos (E, dl). Работа, совершаемая электрическим полем при перемещении заряда q из точки 1 в точку 2, определяется следующим образом:
. Проекция отрезка dl на направление вектора E (рис. 1.5) есть dr = dl cos (E, dl). Работа, совершаемая электрическим полем при перемещении заряда q из точки 1 в точку 2, определяется следующим образом:
 Отсюда следует, что работа сил электрического поля не зависит от формы пути, а определяется только начальным и конечным положениями заряда q. Если оба заряда, q и Q, положительны, то работа сил поля положительна при удалении зарядов и отрицательна при их взаимном сближении.
Для электрического поля, созданного системой зарядов Q1, Q2,¼, Qn, работа перемещения заряда q равна алгебраической сумме работ составляющих сил:
Отсюда следует, что работа сил электрического поля не зависит от формы пути, а определяется только начальным и конечным положениями заряда q. Если оба заряда, q и Q, положительны, то работа сил поля положительна при удалении зарядов и отрицательна при их взаимном сближении.
Для электрического поля, созданного системой зарядов Q1, Q2,¼, Qn, работа перемещения заряда q равна алгебраической сумме работ составляющих сил:
|
 .Таким же образом, как и каждая из составляющих работ, суммарная работа зависит только от начального и конечного положений заряда q.
.Таким же образом, как и каждая из составляющих работ, суммарная работа зависит только от начального и конечного положений заряда q.
Циркуляция вектора напряженности электрического поля.Работа, совершаемая силами электрического поля при перемещении единичного положительного заряда по замкнутому контуру длиной l, определяется как циркуляция вектора напряженности электрического поля:
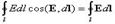 Так как для замкнутого пути положения начальной и конечной точек перемещения заряда совпадают, то работа сил электрического поля на замкнутом пути равна нулю, а значит, равна нулю циркуляция вектора напряженности, т.е.
Так как для замкнутого пути положения начальной и конечной точек перемещения заряда совпадают, то работа сил электрического поля на замкнутом пути равна нулю, а значит, равна нулю циркуляция вектора напряженности, т.е.  .
.
26. Потенциальная энергия точечного заряда в электрическом поле.
работа консервативных сил совершается за счет убыли потенциальной энергии, значит выражение (18) можно представить так:
 (19)
(19)
Т.е. потенциальная энергия заряда  в поле заряда
в поле заряда 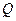 равна
равна  (20)
(20)
Если поле создается системой n зарядов 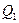 ,
, 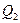 , …,
, …, 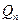 , то потенциальная энергия заряда
, то потенциальная энергия заряда  , который находится в поле этих зарядов, будет равна сумме потенциальных энергий каждого из зарядов в отдельности:
, который находится в поле этих зарядов, будет равна сумме потенциальных энергий каждого из зарядов в отдельности:

27. Потенциал. Связь между потенциалом и напряженностью электрического поля.
Потенц.-скал.физ.вел., кот.явл.энергитич.хар-кой поля и равна отнош.заряд. в этом поле к велич.этого заряда.
n
φ=φ1+φ2+…+φn=Σφi
i=1
Связь потенциала с напряженностью
т.е. напряженность поля Е равна градиенту потенциала со знаком «-». Знак «-»…E=(1/4Πε0)*(q/r2)*e
Потенциал: φ=(1/4Πε0)*(q/r) k=1/4Πε0; φ(r)=kq/rЭнергия заряженного проводника.
Проводник имеет заряд q,наход. на некот. проводн.,можно рассм.как систему точ.зарядов Δq.
n
Wп=1/2φ∑qi=φq/2
i=1
Wn=φq/2=q2/2c=φ2c/2
φi-потенц.,созд.всеми зарядами,кроме qi в той точ,где помещ. qi.