рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Реакции с участием гидроксильной группы.
Реферат Курсовая Конспект
Реакции с участием гидроксильной группы.
Реакции с участием гидроксильной группы. - раздел Образование, Модуль I Классификация спиртов 1. Диссоциация В Водных Растворах: ...
1. Диссоциация в водных растворах:
 фенолят - ион
фенолят - ион
2. Взаимодействие с активными металлами (сходство с простыми спиртами):
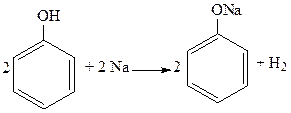
3. Взаимодействие со щелочами (отличие от спиртов):

Образующиеся феноляты легко разлагаются при действии кислот. Поэтому при действии Н2СО3 (СО2 + Н2О) и др. кислот феноляты легко разлагаются и обратная реакция не возможна.
С6Н5ОNа + СО2 + Н2О ® С6Н5ОН + NаНСО3
4. Взаимодействие с галогеналканами с образованием простых эфиров:
 метилфениловый эфир
метилфениловый эфир
5. Взаимодействие с ангидридами кислот с образованием сложных эфиров:
 фенилацетат
фенилацетат
6. Взаимодействие с солями (хлоридом железа III). Данная реакция является качественной реакцией на фенольный гидроксид
Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13:
Фенол ® Фиолетовое, Гидрохинон ® Грязно-зеленое,
Пирокатехин ® Зеленое, Пирогаллол ® Красное.
Резорцин ® Фиолетовое
3С6Н5ОН + FеС13 ® (С6Н5О)3Fе¯ + 3НС1
Фиолетовое окрашивание
7. Р-ция восстановления с цинковой пылью при нагревании:
С6Н5ОН + 3Н2 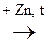 С6Н12 + ZnО
С6Н12 + ZnО
1.1. .Р-ции по бензольному кольцу (SЕ )
Как было сказано выше, –ОН группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и пара- положения:
1. Галогенирование фенола:
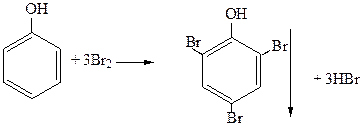 2,4,6-трибромфенол
2,4,6-трибромфенол
Происходит обесцвечивание бромной воды и образование белого осадка. Эта реакция используется как качественная реакция на фенол.
2. Нитрование фенола. Под действием 20% раствора азотной кислоты на холожу фенол превращается в смесь орто- и пара-нитрофенол:

2-нитрофенол – 40% 4-нитрофенол – 10%
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) фенол предварительно растворяют в концентрированной серной кислоте, а зате6м подвергают нитрованию концентрированной азотной кислотой:
 пикриновая кислота
пикриновая кислота
3. Сульфирование фенола:

4. Р-ция конденсации. При взаимодействии с формальдегидом фенол образует полимеры различного строения (линейного, разветвленного, сетчатого) – фенолформальдегидные смолы.


Фрагмент
фенолоформальдегидной
смолы
5.Р-ция гидрирования (восстановление):

1. Окисление. Фенолы легко окисляются под действием кислорода воздуха:
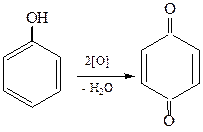 хинон
хинон
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.
2. Фенол. Резорцин. Адреналин. Применение в медицине. Трехатомные фенолы.
Фенол и его производные обладают дезинфицирующим свойством.. Карболовая к-та – 3%-ный раствор фенола – для дезинфекции хирургических инструментов. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей.
Резорцин – используется при лечении кожных заболеваний в составе примочек или мазей.
Гидрохинон – в организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспоста электронов от окисляемого субстрата к кислороду.
Пирокатехин применяется для синтеза адреналина – гормона надпочечников. Адреналин является одним из важнейших регуляторов жизнедеятельности организма. Это первый гормон, который удалось получить синтетически.
Амины - Это производные аммиака NH3, где один, два или три атома Н замещены на радикал R (алифатический или ароматический).
– Конец работы –
Эта тема принадлежит разделу:
Модуль I Классификация спиртов
I По количеству групп ОН различают одноатомные двухатомные и многоатомные спирты... СН СН ОН... Этанол Этиленгликоль Глицерин...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реакции с участием гидроксильной группы.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов