Формулировки - Лекция, раздел Химия, Курс лекций по физической химии 6.1.1. Тепловая Теорема Нернста (1906 Г.)
При Темпе...
6.1.1. Тепловая теорема Нернста (1906 г.)
При температуре, близкой к абсолютному нулю, многие свойства системы становятся независимыми от температуры, т.е. становятся постоянными, например теплоты химических реакций, объем системы, поверхностное натяжение и др.
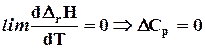 . (6.8)
. (6.8)
Теплоемкости всех веществ становятся одинаковыми и стремятся к 0. Изменение энтропии при всех процессах при абсолютном нуле равно 0.
6.1.2. Постулат Планка: энтропия идеального кристаллического тела при абсолютном нуле равна 0. Статистическое обоснование постулата Планка – все частицы находятся на низшем энергетическом уровне, т.е. занимают 1 ячейку фазового пространства. Термодинамическая вероятность такого состояния равна 1, а энтропия = 0.
6.1.3. Недостижимость абсолютного нуля . Охлаждение достигается за счет
адиабатического расширения (DТ < 0) и изотермического сжатия (DS < 0), при последнем процессе нужно отводить тепло, что возможно только к менее нагретому телу. При абсолютном нуле невозможно понизить энтропию, поэтому абсолютный нуль недостижим, хотя в настоящее время достигнуты температуры в несколько тысячных градуса Кельвина.
Все темы данного раздела:
Предмет, структура и методы физической химии.
1.1. Физическая химия изучает общие вопросы химического строения веще-ства, общие количественные закономерности химического равновесия и химических процессов, а также физических явлений, которые их
Термодинамические системы .
2.1.1. Термодинамическая система – это часть материального мира, отделенная от окружающей среды реальными или воображаемыми границами и являющаяся объектом исследования. Окр
По составу
Термодинамическая система состоит из компонентов. Компонент - это вещество, которое может быть выделено из системы и существовать вне ее, т.е. компоненты – это независимые в
Определение.
Состояние ТДС – это совокупность всех ее измеримых макроскопических свойств, имеющих, следовательно, количественное выражение. Макроскопический характер свойств означает, что и
Равновесие
Классическая термодинамика обычно ограничивается рассмотрением равновесных состояний ТДС. Равновесие - это такое состояние, к которому самопроизвольно приходит ТДС, и в кото
Внутренняя энергия как функция состояния системы
Циклический процесс Нециклический процесс (1→2)
p1 V1, T1 p1 V1, T1
Изохорное нагревание
dQv = n CvdT = dUv ê: n Þ dUV = CvdT Þ Cv =
Изотермическое расширение идеального газа
U = f(T). dUТ = 0
dQ = dWрасшир. = pdV;
Q = W =
Стехиометрическое уравнение химической реакции и химическая переменная.
Обычная запись уравнения химической реакции
ênA ê A + ênB êB = nC C + nD D,
или в общем виде
Теплоты химических реакций и их связь с изменением термодина-мических функций.
4.2.2.1. Теплота при постоянном объеме
Теплотой химической реакции называют количество те
Формулировка
Теплота реакции не зависит от пути протекания процесса, т.е. промежуточных химических стадий, через которые он проходит, а только от начального и конечного состояния веществ. З
Расчет изменеия термодинамических функций в химических реакциях
По закону Гесса теплоту реакции можно представить в виде суммы изменения внутренней энергии всех веществ, участвующих в реакции
Первое следствие.
4.4.1.1. Понятие стандартной теплоты образования вещества
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать
Экспериментальное определение теплот реакций.
4.4.2.1. Калориметрия – метод непосредственного экспериментального измерения теплот химических реакций в приборе, называемом калори-метром. Различают калориметры
Теплота реакция равна сумме теплот сгорания реагентов минус сумма теплот сгорания продуктов с учетом модулей стехио-метрических коэффициентов.
4.4.3. 3-ье следствие из закона Гесса – пересчет экспериментальных теплот сгорания на теплоты образования
3 Сграф. + 3 Н2 + 1/2О2
Приближенный расчет теплот химических реакций по знергиям связи
4.5.1. Энергия связи – это средняя энергия, необходимая для разрыва связи в 1 моле газообразного вещества до состояния газообразных атомов:
HClгаз
Теплота растворения
Раствор – это фаза переменного состава, существующая в определенных пределах термодинамических параметров. Раствор – гомогенная система, состоящая из двух или более компонентов. Свойства раствора з
Зависимость теплоты реакции от температуры
Реагенты Т1 Продукты Т1 ; DrHт1
Зависимость теплоемкости от температуры для идеального газа
4.8.1.1. Связь Ср и Сv
Сv = Сp
Энергия молекул как сумма энергий различного вида движения
Внутренняя энергия – это сумма энергии частиц, составляющих термодинамическую систему. В идеальном газе отсутствует энергия взаимодействия молекул, поэтому внутренняя энергия определяется как сумма
Теплоемкость твердых тел
В твердом теле единственным видом движения является колебания элементов кристаллической решетки, ячейки которой повторяются в пространстве. Твердое тело (например, металл) можно представить как наб
Анализ уравнения Кирхгоффа
4.8.5.1. DrСр = 0 DrНT1= DrНT2 . Теплота реакции не зависит
Интегрирование уравнения Кирхгоффа
4.8.6.1. Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл
Второй закон термодинамики
Первый закон термодинамики устанавливает эквивалентность различных видов энергии и форм их передачи. 2-ой закон термодинамики говорит скорее об обратном. Теплота и работа в определенном смысле неэк
Для каждой фазы a, содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
Sa = Sa(Ua, Va, n1a, na2 , ..nak);
Изменение температуры в закрытой сиситеме
5.3.1.1. V = const. dS = =
Изотермическое расширение-сжатие идеального газа
dS = ; DS =
P,T p,T p,T
nk/ Snk = Nk мольная доля
DS = DSa + DS
Химические реакции
DrS = SnjSj - S½ni½Si = SnkSk.(5.12)
Статистический смысл энтропии
Термодинамические соотношения не зависят от природы веществ, но термодинамические свойства индивидуальных соединений находят опытным путем. Задача статистической термодинамики – определение характе
Термодинамическая вероятность.
5.5.3.1. В равновесии термодинамические параметры системы постоянны , но микрохарактеристики молекул претерпевают непрерывные изменения. Таким образом, макросостояния системы реализуется множеством
Процессы , ведущие к увеличению энтропии
5.5.5.1. Увеличение числа частиц, например, распад молекул, диссоциация.
5.5.5.2. Увеличение объема фазового пространства, т.е. увеличение числа ячеек, или возможных состояний.
а)
Остаточная энтропия
Реальные кристаллы могут иметь дефекты – дырки по Шоттки и Френкелю, дислокации, нарушения кристаллической решетки, основной уровень может быть вырожденным. В этих случаях энтропия при абсолютном н
Фундаментальное уравнение Гиббса
Уравнение 2-го закона не очень удобно для использования, так как в нем характеристики системы выражаются через функции процесса. Желательно, чтобы свойства системы выражались через ее параметры. Дл
Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы.
Фундаментальные уравнения Гиббса определяют свойства термодинамических систем, когда в качестве независимых переменныых выступают экстенсивные параметры (U, VилиS, V),
Физический смысл
Проинтегрируем фундаментальное уравнение Гиббса при T, p = const
dU - TdS + pdV £ - dW’
d(U –TS +PV) £ - dW’
D(U –TS
Характеристические функции
7.3.1. Определение. Характеристические функции - это экстенсивные функции состояния системы, посредством которых, а также производных от них различных порядков по
Полные дифференциалы и частные производные характеристиче-ских функций в закрытых системах (урпанения Массье)
dU = TdS – pdV Эти выражения получились как преобразования
dН = TdS – Vdp фундаментального уравнения Гиббса к другим
dA = –SdT – pdV
Зависимость энергии Гиббса от температуры и давления
G º U + pV– TS º H – TS(7.21)
DG pT º D H -TDS, D rG pT º D rH -TDrS(7.22)
Фундаментальное уравнение Гиббса для открытых систем
8.1. Дифференциалы характеристических функций
dU = TdS – pdV - dW’
Гиббс ввел в качестве переменной массу, а точнее количество м
Понятие химического потенциала.
mka - химический потенциал всегда является интенсивной характеристикой состояния компонента k в фазе a.
Уравнение Гиббса-Дюгема
Напишем полный дифференциал внутренней энергии из определения (8.7)
dU = TdS + SdT – pdV – Vdp +
Выражение химического потенциала компонента идеального газа
8.5.1. Чистое вещество в закрытой системе (n = const)
m = G/n = G.
dG = - SdT + Vdp
Смесь газов
Рассмотрим процесс смешения: исходное состояние – 2 газа в стандартных условиях, конечное состояние смесь газов при той же температуре и том же общем давлении.
Коэффициент летучести. Стандартные состояния.
m
1
Общее условие химического равновесия в закрытой системе
В химической реакции происходит изменение числа молей компонентов в соответствии со стехиометрическим уравнением 0 =S nkAk. Этим системы с химическими реакция
Гомогенные газовые реакции
Уравнение изотермы химической реакции определяет изменение энергии Гиббса за один пробег (=1) химической реакции при пос
Гетерогенные реакции
Такие реакции протекают на границе раздела фаз. Рассмотрим реакцию
FeOтв. + H2газ = Feтв. + H2Oж.
n -1 -1 1
Влияние давления на направление реакции
Уравнение изотермы химической реакции позволяет определить, как изменяется направление реакции, если мы изменяем общее давление в системе
3/2 H2 + 1/2N2 = NH
Константа равновесия
DGpT = DGT0+ RT lnP p*knk = DGT0 + RT ln
Идеальный газ при постоянном давлении и температуре
Парциальные давления компонентов газовой смеси можно выразить через их мольные доли и общее давление в системе р*к = робщ.хk, отсюда
Идеальный газ при постоянном объеме и температуре
pV = nRT, p = nRT/V = cRT
Kp = = P C*kn
Вывод уравнения Вант-Гоффа
Для вывода потребуются 2 уравнения:уравнение Гиббса-Гельмгольца (7.30) и уравнение изотермы химической реакции – DrGTº = RT ln Kp.
Использование уравнения Вант-Гоффа
9.4.3.1. Определение DrHº по температурной зависимости константы равновесия
а) две точки в небольшом интервале температур, Dr
Экспериментальное определение констант равновесия.
-DrGºT = RT ln Kp. Положительное значение DrGºTне означает, что реакция вообще не может идти, она
Статистические расчеты констант равновесия
Все термодинамические функции выражаются через статистические суммы веществ
Q = Si gi exp(-ei/kT)
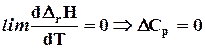 . (6.8)
. (6.8)






Новости и инфо для студентов