Первое следствие. - Лекция, раздел Химия, Курс лекций по физической химии 4.4.1.1. Понятие Стандартной Теплоты Образования Вещества
Согласно 1...
4.4.1.1. Понятие стандартной теплоты образования вещества
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать для различных веществ условный нуль, относительно которого определяются изменения внутренней энергии. За такой уровень отсчета приняты состояния простых веществ при стандартных условиях. Простые вещества образованы из атомов одного элемента. Если элемент существует в нескольких простых формах, то выбирается наиболее устойчивая модификация H2(газ), O2 (газ), N2(газ), Ar(газ) , Cграфит, S(ромб), Br2(ж)
Стандартная теплота образования – это тепловой эффект реакции образования вещества из простых веществ в стандартных состояниях. Обозначается DfH˚ или DfU˚, для простых веществ DfH˚=DfU˚= 0.
Пример,
Cграф. + 1/2 O2 + 3 H2 = C2 H5 OH(жидк.) ; DrH˚= DfH˚
4.4.1.2. Стандартное состояние – наиболее устойчивая форма чистого вещества, для газов – давление 1 атмосфера и газ должен обладать свойствами идеального газа, т.е. для него справедливо уравнение Менделеева-Клапейрона, конденсированные фазы находятся в равновесии со своим паром. Температура не входит в понятие стандартного состояния. Оно возможно при любой температуре. В справочниках теплоты образования приводятся при температуре 298,15 К, но это специально оговаривается DfH˚298.
4.4.1.3. 1-ое следствие из закона Гесса используется для определения теплот химических реакций по справочным данным, т.е. по теплотам образования веществ
0 = 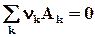 ;
; 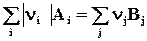 DrH˚-?
DrH˚-?
 DrH˚
DrH˚

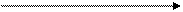 Реагенты Продукты
Реагенты Продукты



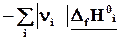 Простые вещества
Простые вещества 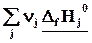
Простые вещества одинаковы для реагентов и продуктов, поэтому
 DrH˚=
DrH˚= 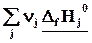
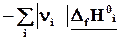 =
= 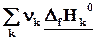 (3.1)
(3.1)
Теплота реакции равна сумме теплот образования конечных веществ минус сумма теплот образования исходных веществ с учетом модуля стехиометрических коэффициентов.
Все темы данного раздела:
Предмет, структура и методы физической химии.
1.1. Физическая химия изучает общие вопросы химического строения веще-ства, общие количественные закономерности химического равновесия и химических процессов, а также физических явлений, которые их
Термодинамические системы .
2.1.1. Термодинамическая система – это часть материального мира, отделенная от окружающей среды реальными или воображаемыми границами и являющаяся объектом исследования. Окр
По составу
Термодинамическая система состоит из компонентов. Компонент - это вещество, которое может быть выделено из системы и существовать вне ее, т.е. компоненты – это независимые в
Определение.
Состояние ТДС – это совокупность всех ее измеримых макроскопических свойств, имеющих, следовательно, количественное выражение. Макроскопический характер свойств означает, что и
Равновесие
Классическая термодинамика обычно ограничивается рассмотрением равновесных состояний ТДС. Равновесие - это такое состояние, к которому самопроизвольно приходит ТДС, и в кото
Внутренняя энергия как функция состояния системы
Циклический процесс Нециклический процесс (1→2)
p1 V1, T1 p1 V1, T1
Изохорное нагревание
dQv = n CvdT = dUv ê: n Þ dUV = CvdT Þ Cv =
Изотермическое расширение идеального газа
U = f(T). dUТ = 0
dQ = dWрасшир. = pdV;
Q = W =
Стехиометрическое уравнение химической реакции и химическая переменная.
Обычная запись уравнения химической реакции
ênA ê A + ênB êB = nC C + nD D,
или в общем виде
Теплоты химических реакций и их связь с изменением термодина-мических функций.
4.2.2.1. Теплота при постоянном объеме
Теплотой химической реакции называют количество те
Формулировка
Теплота реакции не зависит от пути протекания процесса, т.е. промежуточных химических стадий, через которые он проходит, а только от начального и конечного состояния веществ. З
Расчет изменеия термодинамических функций в химических реакциях
По закону Гесса теплоту реакции можно представить в виде суммы изменения внутренней энергии всех веществ, участвующих в реакции
Экспериментальное определение теплот реакций.
4.4.2.1. Калориметрия – метод непосредственного экспериментального измерения теплот химических реакций в приборе, называемом калори-метром. Различают калориметры
Теплота реакция равна сумме теплот сгорания реагентов минус сумма теплот сгорания продуктов с учетом модулей стехио-метрических коэффициентов.
4.4.3. 3-ье следствие из закона Гесса – пересчет экспериментальных теплот сгорания на теплоты образования
3 Сграф. + 3 Н2 + 1/2О2
Приближенный расчет теплот химических реакций по знергиям связи
4.5.1. Энергия связи – это средняя энергия, необходимая для разрыва связи в 1 моле газообразного вещества до состояния газообразных атомов:
HClгаз
Теплота растворения
Раствор – это фаза переменного состава, существующая в определенных пределах термодинамических параметров. Раствор – гомогенная система, состоящая из двух или более компонентов. Свойства раствора з
Зависимость теплоты реакции от температуры
Реагенты Т1 Продукты Т1 ; DrHт1
Зависимость теплоемкости от температуры для идеального газа
4.8.1.1. Связь Ср и Сv
Сv = Сp
Энергия молекул как сумма энергий различного вида движения
Внутренняя энергия – это сумма энергии частиц, составляющих термодинамическую систему. В идеальном газе отсутствует энергия взаимодействия молекул, поэтому внутренняя энергия определяется как сумма
Теплоемкость твердых тел
В твердом теле единственным видом движения является колебания элементов кристаллической решетки, ячейки которой повторяются в пространстве. Твердое тело (например, металл) можно представить как наб
Анализ уравнения Кирхгоффа
4.8.5.1. DrСр = 0 DrНT1= DrНT2 . Теплота реакции не зависит
Интегрирование уравнения Кирхгоффа
4.8.6.1. Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл
Второй закон термодинамики
Первый закон термодинамики устанавливает эквивалентность различных видов энергии и форм их передачи. 2-ой закон термодинамики говорит скорее об обратном. Теплота и работа в определенном смысле неэк
Для каждой фазы a, содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
Sa = Sa(Ua, Va, n1a, na2 , ..nak);
Изменение температуры в закрытой сиситеме
5.3.1.1. V = const. dS = =
Изотермическое расширение-сжатие идеального газа
dS = ; DS =
P,T p,T p,T
nk/ Snk = Nk мольная доля
DS = DSa + DS
Химические реакции
DrS = SnjSj - S½ni½Si = SnkSk.(5.12)
Статистический смысл энтропии
Термодинамические соотношения не зависят от природы веществ, но термодинамические свойства индивидуальных соединений находят опытным путем. Задача статистической термодинамики – определение характе
Термодинамическая вероятность.
5.5.3.1. В равновесии термодинамические параметры системы постоянны , но микрохарактеристики молекул претерпевают непрерывные изменения. Таким образом, макросостояния системы реализуется множеством
Процессы , ведущие к увеличению энтропии
5.5.5.1. Увеличение числа частиц, например, распад молекул, диссоциация.
5.5.5.2. Увеличение объема фазового пространства, т.е. увеличение числа ячеек, или возможных состояний.
а)
Формулировки
6.1.1. Тепловая теорема Нернста (1906 г.)
При температуре, близкой к абсолютному нулю, многие свойства системы становятся независимыми от температуры, т.е. становятся пост
Остаточная энтропия
Реальные кристаллы могут иметь дефекты – дырки по Шоттки и Френкелю, дислокации, нарушения кристаллической решетки, основной уровень может быть вырожденным. В этих случаях энтропия при абсолютном н
Фундаментальное уравнение Гиббса
Уравнение 2-го закона не очень удобно для использования, так как в нем характеристики системы выражаются через функции процесса. Желательно, чтобы свойства системы выражались через ее параметры. Дл
Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы.
Фундаментальные уравнения Гиббса определяют свойства термодинамических систем, когда в качестве независимых переменныых выступают экстенсивные параметры (U, VилиS, V),
Физический смысл
Проинтегрируем фундаментальное уравнение Гиббса при T, p = const
dU - TdS + pdV £ - dW’
d(U –TS +PV) £ - dW’
D(U –TS
Характеристические функции
7.3.1. Определение. Характеристические функции - это экстенсивные функции состояния системы, посредством которых, а также производных от них различных порядков по
Полные дифференциалы и частные производные характеристиче-ских функций в закрытых системах (урпанения Массье)
dU = TdS – pdV Эти выражения получились как преобразования
dН = TdS – Vdp фундаментального уравнения Гиббса к другим
dA = –SdT – pdV
Зависимость энергии Гиббса от температуры и давления
G º U + pV– TS º H – TS(7.21)
DG pT º D H -TDS, D rG pT º D rH -TDrS(7.22)
Фундаментальное уравнение Гиббса для открытых систем
8.1. Дифференциалы характеристических функций
dU = TdS – pdV - dW’
Гиббс ввел в качестве переменной массу, а точнее количество м
Понятие химического потенциала.
mka - химический потенциал всегда является интенсивной характеристикой состояния компонента k в фазе a.
Уравнение Гиббса-Дюгема
Напишем полный дифференциал внутренней энергии из определения (8.7)
dU = TdS + SdT – pdV – Vdp +
Выражение химического потенциала компонента идеального газа
8.5.1. Чистое вещество в закрытой системе (n = const)
m = G/n = G.
dG = - SdT + Vdp
Смесь газов
Рассмотрим процесс смешения: исходное состояние – 2 газа в стандартных условиях, конечное состояние смесь газов при той же температуре и том же общем давлении.
Коэффициент летучести. Стандартные состояния.
m
1
Общее условие химического равновесия в закрытой системе
В химической реакции происходит изменение числа молей компонентов в соответствии со стехиометрическим уравнением 0 =S nkAk. Этим системы с химическими реакция
Гомогенные газовые реакции
Уравнение изотермы химической реакции определяет изменение энергии Гиббса за один пробег (=1) химической реакции при пос
Гетерогенные реакции
Такие реакции протекают на границе раздела фаз. Рассмотрим реакцию
FeOтв. + H2газ = Feтв. + H2Oж.
n -1 -1 1
Влияние давления на направление реакции
Уравнение изотермы химической реакции позволяет определить, как изменяется направление реакции, если мы изменяем общее давление в системе
3/2 H2 + 1/2N2 = NH
Константа равновесия
DGpT = DGT0+ RT lnP p*knk = DGT0 + RT ln
Идеальный газ при постоянном давлении и температуре
Парциальные давления компонентов газовой смеси можно выразить через их мольные доли и общее давление в системе р*к = робщ.хk, отсюда
Идеальный газ при постоянном объеме и температуре
pV = nRT, p = nRT/V = cRT
Kp = = P C*kn
Вывод уравнения Вант-Гоффа
Для вывода потребуются 2 уравнения:уравнение Гиббса-Гельмгольца (7.30) и уравнение изотермы химической реакции – DrGTº = RT ln Kp.
Использование уравнения Вант-Гоффа
9.4.3.1. Определение DrHº по температурной зависимости константы равновесия
а) две точки в небольшом интервале температур, Dr
Экспериментальное определение констант равновесия.
-DrGºT = RT ln Kp. Положительное значение DrGºTне означает, что реакция вообще не может идти, она
Статистические расчеты констант равновесия
Все термодинамические функции выражаются через статистические суммы веществ
Q = Si gi exp(-ei/kT)
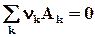 ;
; 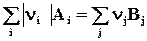 DrH˚-?
DrH˚-? DrH˚
DrH˚
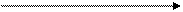 Реагенты Продукты
Реагенты Продукты




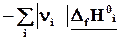 Простые вещества
Простые вещества 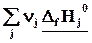
 DrH˚=
DrH˚= 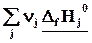
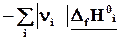 =
= 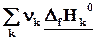 (3.1)
(3.1)






Новости и инфо для студентов