Программа и контрольные задания по «Физической химии»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Институт металлургии и химии

Кафедра химии
Программа и контрольные задания
по «Физической химии»
для студентов заочной формы обучения
Учебно-методическое пособие
Специальность: 2502 – химическая технология
неорганических веществ; 1705 – машины
и аппараты химических производств
ЧЕРЕПОВЕЦ
Пособие включает в себя программу дисциплины «Физическая химия» и варианты контрольных заданий для студентов-заочников…ВВЕДЕНИЕ
Дисциплина «Физическая химия» содержится в Государственных образовательных стандартах химических и отдельных инженерно-технических специальностей. Изучение данного предмета дает возможность понимать, предсказывать и управлять физико-химическими явлениями и системами, лежащими в основе производственных многих процессов.
При изучении курса студентам рекомендуется следующий порядок работы: а) внимательно ознакомиться с программой и подготовить литературу; б) выбрать тему, прочитать соответствующие разделы учебников и составить краткий конспект; в) разобрать примеры решения типовых задач по данной теме, а затем приступать к выполнению контрольной работы.
Студент должен выполнить от 1 до 5 контрольных работ (по указанию преподавателя). Если требуется выполнить нескольких контрольных работ в одном семестре, то решать их следует в том порядке, в котором они представлены в данном пособии. При решении многовариантных задач необходимо отвечать на вопросы в той последовательности, в какой они написаны в условии задачи. Для решения задач некоторых разделов физической химии требуется использование справочные данных по физико-химическим величинам.
Графики, которые необходимо выполнить, вычерчиваются на миллиметровой бумаге. Размер графика должен быть не менее 10´10 см, а на оси координат нанесены линии масштаба через равные интервалы. При необходимости величину по оси можно откладывать не с нулевого значения.
ПРОГРАММА
Теоретическая подготовка инженера по специальностям «Химическая технология неорганических веществ» и «Машины и аппараты химических производств и… В результате усвоения настоящей программы студент должен знать теоретические… Студент должен уметь применять на практике основные законы термодинамики и учений о равновесиях и направленности…ЛИТЕРАТУРА
Основная
2. Физическая химия /Под ред. К.С. Краснова. – М.: Высшая школа, 1995. - 687 с. 3. Фролов Ю.Г., Белик В.В. Физическая химия. - М.: Химия. 1993. 4. Полторак О.М. Термодинамика в физической химии. - М.: ВШ, 1991. - 319с.Дополнительная
2. Киреев В.А. Курс физической химии. - М.: 1989. 3. Эткинс П. Физическая химия. – М.: Мир, 1980. т.1. - 582 с., т.2. - 584… 4. Глазов В.М. Основы физической химии. – М.: ВШ, 1981. - 456 с.З а д а н и е 1
Для химической реакции с участием газообразных веществ, приведенной в табл.1, произвести следующие термодинамические расчеты: 1. Рассчитать тепловой эффект реакции при стандартной температуре при… 2. Вычислить тепловой эффект реакции при температурах Т1, Т2, Т3 по температурным зависимостям теплоемкостей.…Вычислите DS при переходе 1 г воды при 273 К в пар при 150 °С, если теплота испарения воды при нормальной температуре кипения равна 9,82 ккал/моль, а теплоемкости воды СР, жид = 75,6 , СР, газ = 0,477 .
23. В сосуд, содержащий 1 дм3 воды при 20 °С, поместили кусок железа массой 100 г, нагретый до 473 К. Чему равно DS каждого тела и системы в целом при достижении температурного равновесия. Систему считать изолированной, а теплоемкости железа и воды принять равными 6,1 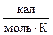 и 75,6
и 75,6 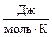 соответственно. Плотность воды r = 0,9975 г/см3.
соответственно. Плотность воды r = 0,9975 г/см3.
24. 2 кг свинца нагрели до Тпл = 327,3 °С и поместили в сосуд, содержащий 3,5 дм3 воды, начальная температура которой равна 15 °С. Вычислите DS каждого тела при достижении телами равенства температур, если система изолирована, плотность воды r = 0,9954 г/см3, а теплоемкости веществ равны: СР(Pb) = 5,77 + 2,02×10-3×Т 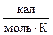 ; СР(Н2Ожид) = 75,6
; СР(Н2Ожид) = 75,6 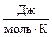 .
.
25. Вычислите DS в процессе охлаждения 300 г жидкого цинка от 500 °С до 273 К, если Тпл = 420 °С, lпл = 7,28 кДж/моль, а теплоемкости твердого и жидкого Zn равны: СР,тв = 5,25 + 2,70×10-3×Т 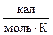 ; СР,жид = 7,5
; СР,жид = 7,5 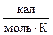 .
.
З а д а н и е 3
1. Давление паров натрия при 827°С равно 60488 Н/м2. Определите давление паров натрия при 927°С, если теплота испарения натрия в рассматриваемом… 2. Удельный объем льда при 273 К равен 1,091 см3/г, а молярный объем воды при… 3. Вычислите плотность жидкого кадмия при Тпл = 321°С, если lпл кадмия 1,53 ккал/моль, плотность твердого Cd 8,64…КОНТРОЛЬНАЯ РАБОТА 2
по теме «Равновесие в системах «твердое тело – жидкость»»
З а д а н и е 1
Построить диаграмму фазового состояния (диаграмму плавкости системы А – В) на основании данных о температурах начала кристаллизации двухкомпонентной… 1) обозначить точками: I - жидкий плав , содержащий а% вещества А при… 2) определить составы химических соединений;КОНТРОЛЬНАЯ РАБОТА 3
по теме «Термодинамика растворов»
З а д а н и е 1
а) Выразить концентрацию водного раствора через молярность, моляльность, мольные доли и нормальность. Таблица 4 № варианта Растворенное вещество Масс.% ρ, г/см3 Т, К …КОНТРОЛЬНАЯ РАБОТА 4
по теме «Химическая кинетика и катализ»
З а д а н и е 1
1. До начала реакции 1 литр раствора содержал 35,35 г Na2S2O3 и 18,25 г CH3J. Через 10 минут количество тиосульфата натрия уменьшилось до 27 г, а… 2. Кинетику некоторой реакции исследовали путем титрования проб одинакового… Время, мин Объем титранта, см3 23,6 14,8 …Фенилдиазохлорид разлагается по уравнению С6Н5N2Cl = С6Н5Cl + N2.
При 323 К и давлении 1 атм. были получены данные, приведенные в таблице. Определить порядок реакции и константу скорости реакции.
| Время, мин | ¥ | ||||
| Объем N2, см3 | 19,3 | 32,6 | 45,0 | 50,4 | 68,3 |
9. Разложение перекиси водорода Н2О2 = Н2О + 1/2О2 это реакция первого порядка. При 7°С период полураспада равен 10 минут. Сколько литров кислорода можно получить из 100 г 10 % масс. раствора перекиси при данной температуре и нормальном давлении за 15 минут?
10. Вещество А смешали в равных количествах с веществами В и С (а=в=с=0,1моль/л). Через 1000 секунд 50 % А прореагировало. Определите концентрацию вещества А через 2000 секунд, если данные вещества взаимодействовали по реакции: 1) первого порядка; 2) второго порядка; 3) третьего порядка.
11. Кинетику реакции разложения дибромянтарной кислоты
НООС-СНBr-CHBr-COOH = НООС-CH=CBr-COOH + HBr
(реакция первого порядка) изучали путем титрования проб одинакового объема раствором щелочи. Вычислите среднее значение константы скорости реакции и время, через которое разложится 30 % кислоты. Результаты титрования даны в таблице.
| Время, мин | |||
| Объем щелочи, см3 | 12,11 | 12,44 | 12,68 |
12. В результате реакции формальдегида с перекисью водорода образуется муравьиная кислота НСНО + Н2О2 = НСООН + Н2О (n=2). Если смешать равные объемы 1 М раствора перекиси и 0,01 М раствора формальдегида, то через 45 минут концентрация муравьиной кислоты становится равной 0,00215 моль/л. Определите константу скорости реакции и период полупревращения.
13. Реакция разложения аммиака протекает по уравнению
2NH3 = N2 + 3H2.
Вычислите константу скорости реакции, если начальное давление в системе равнялось 200 мм рт.ст., а во время реакции давление в системе повышалось следующим образом:
| Время, с | ||||||
| DР, Па |
14. Для некоторой реакции второго порядка результаты приведены в таблице
| Время, час | ||||
| Концентрация×103, М | 7,40 | 5,50 | 3,63 | 2,54 |
Исходные концентрации реагентов одинаковые и равны 0,01 М. Покажите графическим методом, что это реакция второго порядка и вычислите среднее значение константы скорости реакции.
15. Кинетику реакции 2А ® В, протекающей в жидкой фазе, изучали спектрофотометрическим методом. Получили следующие данные:
| Время, мин | ¥ | ||||
| Концентрация В, моль/л | 0,089 | 0,153 | 0,200 | 0,230 | 0,312 |
Определите порядок реакции и константу скорости реакции.
16. При изучении кинетики разложения раствора N2O5 в CCl4 получены следующие данные
| Время, мин | ¥ | |||||
| Объем О2, см3 | 11,4 | 19,9 | 23,9 | 27,2 | 29,5 | 34,75 |
Определите порядок реакции и вычислите среднее значение константы скорости реакции.
17. При 298 К константа скорости реакции второго порядка равна 0,056 с-1×л/моль. Определите t1/2 по компоненту В, если в начальный момент времени смешали 250 мл 0,25 М раствора А и 500 мл 0,05 М раствора В.
18. Реакция второго порядка протекает за 20 минут на 25%, если начальные концентрации А и В одинаковы и равны 0,01 моль/л. Определите концентрацию вещества А через 35 минут, если для реакции были взяты равные объемы 0,1 М раствора А и 0,05 М раствора В.
19. Определите порядок реакции С2Н4Огаз = COгаз + CH4,газ и вычислите константу скорости реакции, если общее давление в системе изменялось следующим образом
| Время, мин | ||||||
| Р×10-5, Па | 0,155 | 0,163 | 0,168 | 0,172 | 0,178 | 0,188 |
20. Константа скорости реакции второго порядка равна 5,4 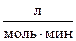 . Вычислите % вещества А, который прореагирует за 10 минут, если исходные концентрации А и В соответственно равны 0,02 и 0,05 моль/л.
. Вычислите % вещества А, который прореагирует за 10 минут, если исходные концентрации А и В соответственно равны 0,02 и 0,05 моль/л.
21. Для реакции 2СО = СО2 + Ств при постоянной температуре в одном опыте общее давление уменьшилось с 786,6 до 693 мм рт.ст. за 30 минут, а в другом - с 535,3 до 468,1 мм рт.ст. за такой же промежуток времени. Определите порядок реакции и вычислите среднее значение константы скорости реакции.
22. Окисление FeCl2 при помощи KClO3 в присутствии HCl - реакция третьего порядка. Константа скорости реакции при температуре 295 К равна 1 мин-1×л2/моль2. Вычислите концентрацию хлорида железа через 2 часа после начала реакции, если исходную смесь приготовили путем сливания равных объемов трех 0,1 М растворов.
23. Радикал ClO. быстро распадается по реакции 2ClO. = Cl2 + O2. При изучении кинетики данной реакции получили следующие данные:
| Время×103, с | 0,12 | 0,62 | 0,96 | 1,60 | 3,20 | 4,00 | 5,75 |
| Концентрация ClO×106, М | 8,49 | 8,09 | 7,10 | 5,79 | 5,20 | 4,77 | 3,95 |
Определите порядок реакции и среднее значение константы скорости реакции.
24. При изучении кинетики гидролиза сахарозы были получены следующие данные
| Время, мин | |||||
| Концентрация С12Н22О11, моль/л | 0,500 | 0,451 | 0,363 | 0,315 | 0,267 |
Определите порядок реакции, значение константы скорости реакции аналитическим и графическим методами.
Изучали кинетику реакции NH4CNO = (NH2)2CO. Цианат аммония массой 22,9 г растворили в воде и объем раствора довели до 1 дм3. Определите порядок, константу скорости реакции и массу цианата через 300 минут после начала реакции, если содержание мочевины в растворе изменялось следующим образом
| Время, мин | |||||
| Масса мочевины, г | 7,0 | 12,1 | 13,8 | 17,7 |
З а д а н и е 2
Для реакции протекающей по n - ному порядку, получены значения констант скорости при различных температурах. Для реакций с n = 1 константа имеет размерность с-1, а для n = 2 размерность будет см3/с.моль. Рассчитать:
1. Энергию активации.
2. Предэкспоненциальный множитель.
3. Теплоту активации.
4. Температурный коэффициент скорости реакции.
5. Количество вещества израсходованное за время τ, если начальные концентрации равны С0 (кмоль/м3 ).
Таблица 9
| № | Реакция | Т, К | k | τ,мин | С0 | |||
Cl
Гидролиз (СН2)6 в этаноле Cl | 1,06.10-5 3,19.10-4 9,86.10-4 2,92.10-3 | 0,03 | ||||||
| N2O5→N2O4+1/2O2 n = 1 | 273,1 288,1 283,1 298,1 | 7,87.10-7 1,05.10-5 1,76.10-5 3,38.10-5 | 0,1 | |||||
| Разложение ацетонодикарбоновой кислоты в водном растворе n = 1 | 273,2 293,2 313,2 333,2 | 2,46.10-5 47,5.10-5 576.10-5 5480.10-5 | 2,83 | |||||
| N2O5→N2O4+1/2O2 n = 1 | 273,2 298,2 308,2 318,2 | 7,67 .10-7 3,46 .10-5 1,46 .10-4 1,98 .10-4 | 1,83 | |||||
| С2Н5Вr→C2Н4+НBr | 4,539.10-3 7,194.10-3 1,125.10-2 1,741.10-2 | 2,38 | ||||||
| N2O4→ 2NO2 n = 1 | 3,288.10-6 6,652.10-6 1,259.10-7 2,398.10-7 | 1,87 | ||||||
| Цикло-(СН3СНО)3→3СН3СНО n = 1 | 5,175.10-5 1,238.10-4 2,345.10-4 6,455.10-4 | 2,83 | ||||||
| СН3СН=СНСН3+HBr→СН3СН2СНBrCH3 | 7,638.10-7 2,055.10-6 6,309.10-6 1,888.10-5 | 1,75 | ||||||
| Н2+С2Н4→С2Н6 n = 2 | 7,413.10-3 1,343.10-2 2,38 .10-2 4,179.10-2 | 0,93 | ||||||
| Н2+J2→2HJ n = 2 | 7,834.10-4 1,714.10-3 3,243.10-3 7,48 .10-3 | 0,87 | ||||||
| HJ+CH3J→CH4+J2 n = 2 | 9,954.10-5 2,780.10-4 7,396.10-4 1,884.10-3 | 2,5 | ||||||
| Н2+J2→2HJ n=2 | 2,938.10-6 7,096.10-6 1,652.10-5 3,732.10-5 | 1,67 | ||||||
| 2NO2→2NO+O2 n = 2 | 1,119.10-4 4,130.10-4 1,119.10-3 2,999.10-3 | 3,85 | ||||||
| СН3СООС2Н5+NaOH→СН3СООNa+ +C2H5OH n = 2 | 24,378 48,865 93,540 122,460 | 104,5 | 0,8 | |||||
| CH3Br+NaJ→CH3J+NaBr n = 2 растворитель – вода | 8,395.10-2 2,075.10-1 7,55.10-1 2,032 | 1,52 | ||||||
2Н2С=НС - CH=СН2 →
 СН2 - СН2 СН2 - СН2
 СН2=С СН СН2=С СН

 CH
СН2 – СН2
n = 2 CH
СН2 – СН2
n = 2
| 0,531 0,751 1,19 1,40 | 0,87 | ||||||
2Н2С=НС - CH=СН2 →
 СН2 - СН2 СН2 - СН2
 СН2=С СН СН2=С СН
 СН
СН2 – СН2
n = 2
СН
СН2 – СН2
n = 2
| 1,70 2,43 4,18 9,85 | 0,96 | ||||||
| СН4+Н2О→СО+3Н2 n = 2 | 0,14.10-4 0,28.10-4 0,14.10-3 0,012 | 0,5 | ||||||
| N2O5→N2O4+1/2O2 n = 2 | 298,1 308,1 313,1 318,1 | 3,38 .10-5 1,35 .10-4 2,47 .10-4 4,98 .10-4 | 0,95 | |||||
| СН4+Н2→С2Н6 n = 2 | 4,18 .10-2 7,15 .10-2 1,99 .10-1 7,59 .10-1 | 1,60 | ||||||
| СН3СН=СНСН3+НBr→ →СН3СН2СНBrCH3 n = 2 | 1,89 .10-5 5,19 .10-5 5,90 .10-4 3,020 .10-3 | 0,03 | ||||||
| Н2+J2→2HJ n = 2 | 7,48 .10-3 1,50 .10-2 2,93 .10-2 5,61 .10-2 | 0,1 | ||||||
| N2O5→N2O4+1/2O2 n = 1 | 318,1 323,1 328,1 338,1 | 4,98 .10-4 7,59 .10-4 1,50 .10-3 4,8 .10-3 | 0,87 | |||||
| 2NO2→2NO+O2 n = 2 | 3,00.10-3 7,50.10-3 1,79.10-2 4,08.10-2 | 1,75 | ||||||
2Н2С=СН – СН=CH2→
 СН2 – СН2 – СН2 СН2 – СН2 – СН2
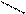 → СН2= С /
СН2 – СН = СН
n = 2 → СН2= С /
СН2 – СН = СН
n = 2
| 9,85 25,4 44,5 84,4 | 1,90 |
КОНТРОЛЬНАЯ РАБОТА 5
по теме «Электрохимические процессы»
З а д а н и е 1
1. Рассчитать, оформить в виде таблицы и построить графики зависимостей удельной, эквивалентной электропроводностей и степени диссоциации от… 2. Рассчитать константы диссоциации электролита для всех концентраций и… 3. Определить, при какой концентрации степень диссоциации вещества в растворе равна 0,1 и чему равно рН данного…З а д а н и е 2
1. ЭДС гальванического элемента, работающего за счет реакции Cd + PbCl2 = CdCl2 + Pb равна 0,1880 В при 298 К, (dE/dT)P = -4,8×10-4 В/К. Вычислите тепловой эффект реакции и изменение энтропии.Содержание
Введение................................................................................................................................. 3
Программа курса ................................................................................................................... 3
Литература ............................................................................................................................. 8
Контрольная работа 1............................................................................................................ 9
Контрольная работа 2............................................................................................................ 16
Контрольная работа 3............................................................................................................ 25
Контрольная работа 4............................................................................................................ 28
Контрольная работа 5............................................................................................................ 35

 водном 80%-м
водном 80%-м