рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Это уравнение необходимо решить для нахождения неполной радиальной функции R(r).
Реферат Курсовая Конспект
Это уравнение необходимо решить для нахождения неполной радиальной функции R(r).
Это уравнение необходимо решить для нахождения неполной радиальной функции R(r). - раздел Химия, Атом водорода и водородоподобные системы Уравнение (7.7) Имеет Решение, Удовлетворяющее Необходимому Условию К...
Уравнение (7.7) имеет решение, удовлетворяющее необходимому условию квадратной интегрируемой функции состояния, если выполняется равенство:
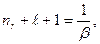
 (7.8)
(7.8)
где 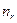 = 1,2,3,… - радиальное квантовое число. Обычно вводят
= 1,2,3,… - радиальное квантовое число. Обычно вводят
главное квантовое число: 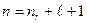 (7.9)
(7.9)
Тогда с учётом значений 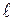 видно, что
видно, что 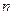 = 1,2,3,…
= 1,2,3,…
Из формулы (7.8) с учётом (7.7) имеем: 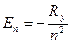 т.е. энергия стационарных состояний квантуется главным квантовым числом n.
т.е. энергия стационарных состояний квантуется главным квантовым числом n.
Таким образом, стационарные состояния электрона в атоме водорода определяются тройкой квантовых чисел n,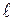 , m. Квантовые числа позволяют рассчитать для каждого состояния значение трёх физических величин, имеющих одновременно определённые значения.
, m. Квантовые числа позволяют рассчитать для каждого состояния значение трёх физических величин, имеющих одновременно определённые значения.
Это энергия момента импульса и его проекция:
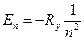 ,
, 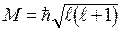 ,
, 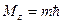 .
.
Согласно формуле (7.9) 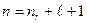 , т.е.
, т.е. 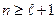 .
.
Поэтому при заданном главном квантовом числе орбитальное квантовое число пробегает n разных значений от 0 до (n-1). При фиксированном n и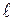 может быть
может быть 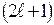 состояний отличающихся значениями магнитного квантового числа. Количество состояний с одним и тем же n, но разными
состояний отличающихся значениями магнитного квантового числа. Количество состояний с одним и тем же n, но разными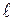 и m равно:
и m равно:
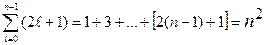 .
.
Состояния с фиксированным n имеют одну и ту же энергию и называются вырожденными. Число этих состояний называют кратностью вырождения, следовательно, 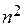 - кратность вырождения уровней энергии электрона в атоме. Полная функция состояния атома водорода − это произведение радиального и углового её соотношений:
- кратность вырождения уровней энергии электрона в атоме. Полная функция состояния атома водорода − это произведение радиального и углового её соотношений:
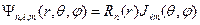 .
.
Исходя из квантово-механической модели установим, каким квантовым переходам в атоме водорода отвечает серия Лаймана. Разрешены не все переходы между стационарными квантовыми состояниями. Ограничений на изменение главного квантового числа нет, разность 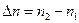 , может быть любой. В отношении орбитального числа действует запрет на любые переходы, кроме тех, для которых
, может быть любой. В отношении орбитального числа действует запрет на любые переходы, кроме тех, для которых 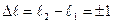 . Магнитное квантовое число должно оставаться прежним или изменяться на единицу:
. Магнитное квантовое число должно оставаться прежним или изменяться на единицу: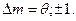 Это правило отбора по квантовым числам
Это правило отбора по квантовым числам 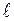 и m.
и m.
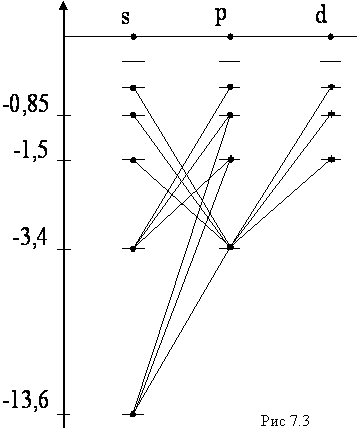 Все состояния делятся на группы, которые называются термами. Терм объединяет состояния со сходными свойствами. Для водорода в соответствии с правилами отбора в термы включают состояния с одним и тем же
Все состояния делятся на группы, которые называются термами. Терм объединяет состояния со сходными свойствами. Для водорода в соответствии с правилами отбора в термы включают состояния с одним и тем же 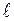 . Соответственно говорят о s-, p-, d- и т.д. термах. Переходы возможны только между соседними термами. Квантовые состояния электрона отличаются символом, состоящим из числа, равного n, и буквы, обозначающей значение
. Соответственно говорят о s-, p-, d- и т.д. термах. Переходы возможны только между соседними термами. Квантовые состояния электрона отличаются символом, состоящим из числа, равного n, и буквы, обозначающей значение 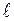 , например 1s, 2p, 2d и т.д. Если атомы не находятся в магнитном поле, то уровни энергии вырождены по квантовому числу m, и поэтому оно существенной роли не играет и в обозначении состояния не присутствует. Расположение самих нижних по энергии квантовых состояний атома водорода иллюстрируется диаграммой (рис. 7.3). Диаграмма наглядно показывает, каким квантовым переходам соответствуют те или иные линии в спектре. Серия Лаймана образуется переходами np→1s (n = 1, 3,…); Серия Бальмера ns→2p, np→2s, nd→2p (n = 3, 4,…). Состояние 1s является основным состоянием атома водорода. В этом состоянии атом обладает минимальной энергией. Чтобы перевести атом в возбуждённое (т.е. в состоянии с большей энергией) ему необходимо сообщить энергию.
, например 1s, 2p, 2d и т.д. Если атомы не находятся в магнитном поле, то уровни энергии вырождены по квантовому числу m, и поэтому оно существенной роли не играет и в обозначении состояния не присутствует. Расположение самих нижних по энергии квантовых состояний атома водорода иллюстрируется диаграммой (рис. 7.3). Диаграмма наглядно показывает, каким квантовым переходам соответствуют те или иные линии в спектре. Серия Лаймана образуется переходами np→1s (n = 1, 3,…); Серия Бальмера ns→2p, np→2s, nd→2p (n = 3, 4,…). Состояние 1s является основным состоянием атома водорода. В этом состоянии атом обладает минимальной энергией. Чтобы перевести атом в возбуждённое (т.е. в состоянии с большей энергией) ему необходимо сообщить энергию.
Это может быть осуществлено за счет теплового соударения атома, за счёт столкновения атома с достаточно быстрым электроном, или за счёт поглощения атомом фотона. Фотон при поглощении атомом, исчезает, передовая атому свою энергию. Атом не может поглотить только часть фотона, ибо фотон, как и электрон, является неделимым. Атом может поглощать только те фотоны, энергия которых в точности соответствует разности энергий двух его уровней. Поскольку поглощающий атом обычно находится в основном состоянии, спектр поглощения водородного атома должен состоять из линий, соответствующих переходам
1s→np (n = 2, 3…).
– Конец работы –
Эта тема принадлежит разделу:
Атом водорода и водородоподобные системы
Атом водорода и водородоподобные системы... Свойства оператора момента импульса и его проекций Собственные значения и... Оператор момента импульса имеет вид Оператор проекций момента импульса...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Это уравнение необходимо решить для нахождения неполной радиальной функции R(r).
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов