рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Гальванічні елементи. Корозія металів
Реферат Курсовая Конспект
Гальванічні елементи. Корозія металів
Гальванічні елементи. Корозія металів - раздел Химия, ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ Електрохімія Вивчає Процеси Перетворення Хімічної Енергії В Е...
Електрохімія вивчає процеси перетворення хімічної енергії в електричну і навпаки.
Електрохімія розглядає виникнення електричного потенціалу на межі поділу двох фаз метал – розчин, утворення електрорушійної сили (ЕРС) у гальванічних елементах, а також явище електролізу.
Гальванічний елемент – це прилад, в якому енергія окислювально-відновної реакції перетворюється безпосередньо в електричну. Прикладом може бути гальванічний мідно-цинковий елемент (елемент Якобі–Даніеля, див. рис.1 на с.18),
(-)Zn½ZnSO4½½CuSO4½Cu (+)
Двома вертикальними рисками позначено межу поділу розчинів обох солей.
У цьому елементі цинковий електрод є анодом, а мідний – катодом. На аноді відбувається окислення (Zn - 2е-=Zn2+), на катоді – відновлення (Cu2++2е-=Cu). Сумарна реакція Zn+Cu2+=Zn2++Cu є джерелом електричного струму.
Електрорушійну силу (ЕРС) гальванічного елемента визначають як різницю електродних потенціалів. При цьому від потенціалу катода віднімають потенціал анода:
ЕРС=Eкатода-Eанода (3)
Приклад 2. Обчислити ЕРС гальванічного елемента Якобі-Даніеля, якщо концентрація розчину ZnSO4 - 0,1 моль/л, а розчину CuSO4 - 2 моль/л.
Розв’язання. Знаходимо потенціал мідного електрода (катода):
 В.
В.
Знаходимо потенціал цинкового електрода (анода):
 В;
В;  В.
В.
Знаходимо ЕРС елемента:
ЕРС=0,35 - (-0,79)=1,14 В.
Гальванічний елемент, що складається із двох однакових електродів, занурених у розчин однорідної солі різних концентрацій, називається концентраційним елементом.
(-)Ag½AgNO3½½AgNO3½Ag (+)
C2 C1
У концентраційних елементах катодом є електрод, що має більшу концентрацію солі C1, анодом – електрод з меншою концентрацією солі C2.
ЕРС таких елементів обчислюють за рівнянням:
 (4)
(4)
До окислювально-відновних відносять гальванічні елементи, в яких реакція окислення або відновлення проходить у розчині без участі матеріалу електрода, останній служить лише провідником електронів. Прикладом окислювально-відновного електрода може бути платина, занурена в розчин солей FeCl2 і FeCl3. Якщо такий електрод з’єднати з будь-яким іншим у замкнутий елемент, то в ньому проходитиме реакція окислення-відновлення.
Fe3++e-=Fe2+
Потенціал такого електрода обчислюють за формулою:
 (5)
(5)
де [oxyd], [red] - концентрація відповідно окисленої і відновленої форми.
Катод – це електрод, на якому відбуваються відновні процеси. Анод – це електрод, на якому проходять окислювальні процеси. У гальванічних елементах катод має позитивний знак /+/; анод – негативний /-/. При електролізі катод негативний, анод – позитивний.
У гальванічних елементах електродний потенціал катода завжди більший, ніж анода.
Приклад 3. Визначити катод і анод для таких двох металів: а) цинк – срібло; б) цинк – магній. Привести схеми цих елементів.
Розв’язання. а)  В;
В; 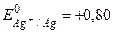 В. Отже цинковий електрод – анод, срібний – катод.
В. Отже цинковий електрод – анод, срібний – катод.
б)  В;
В;  В. Таким чином, цинковий електрод буде катодом, а магнієвий – анодом.
В. Таким чином, цинковий електрод буде катодом, а магнієвий – анодом.
Схеми таких елементів:
а) (-) Zn ½Zn2+ ½½Ag+ ½Ag (+)
б) (-) Mg½Mg2+½½Zn2+½Zn (+)
Корозія – це процес руйнування металу внаслідок хімічної або електрохімічної взаємодії його з навколишнім середовищем: повітрям, водою, газами, розчинами кислот, лугів і солей.
Розрізняють хімічну й електрохімічну корозії. В основі хімічної корозії лежать звичайні хімічні реакції утворення оксидів і солей у середовищах, що не проводять електричного струму (гази при високих температурах, нафтопродукти, мастила, продукти термічної деструкції полімерів).
Електрохімічна корозія виникає в системах, що проводять електричний струм у тих випадках, коли самовільно утворюються гальванічні елементи. Прикладом електрохімічної корозії є корозія чавуну і сталі у вологому середовищі: залізо іржавіє тому, що утворюються гальванічні елементи, в яких катодами є ділянки карбіду заліза Fe3C:
(-) Fe ½H2O, O2½ Fe3C (+)
На анодних ділянках окислюється залізо:
Fe – 2e-= Fe2+
На катодних - відбувається відновлення:
2H2O+O2+4e-=4OH-
Внаслідок вторинних процесів:
Fe2++2OH-=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3=H2O+FeO(OH)
утворюється іржа – суміш нерозчинних продуктів - гідроксидів Fe(OH)2, Fe(OH)3 і оксигідроксидів заліза FeO(OH).
Приклад 4. Написати схеми гальванічних елементів, що утворюються при контактній корозії заліза, покритого цинком, і заліза, покритого оловом.
Розв’язання. У першому випадку утворюється гальванічний елемент
(-) Zn ½H2O, O2½ Fe (+)
в результаті роботи якого руйнується цинк на анодних ділянках:
Zn – 2e-= Zn2+
На катодних ділянках утворюються гідроксид-іони:
2H2O+O2+4e-=4OH-
Утворення гідроксиду цинку – вторинний процес
Zn2++2OH-=Zn(OH)2
У другому випадку виникає гальванічний елемент:
(-) Fe ½H2O, O2½Sn (+)
в результаті роботи якого руйнується залізо на анодних ділянках:
Fe – 2e-= Fe2+
На катодних ділянках утворюються гідроксид-іони, а потім бура іржа
Fe2++2OH-=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
У першому випадку цинк окислюється і захищає залізо від корозії (анодний захист); у другому випадку олово захищає залізо, якщо на поверхні заліза утворюється суцільна без тріщин олов’яна плівка (катодний захист).
Присутність іонів H+, Cl-, Br-, I-, CN-, 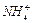 помітно збільшує швидкість корозії.
помітно збільшує швидкість корозії.
Температура досить сильно впливає на швидкість корозії. Як правило, з підвищенням температури швидкість корозії збільшується.
Присутність карбонатів, фосфатів і хроматів сповільнює корозію.
Велике значення у процесах корозії має склад і мікроструктура металу (чим метал однорідніший, тим корозійна стійкість вища).
Для зменшення корозії застосовують різні методи: 1) обробляють навколишнє середовище з метою усунення речовин, які викликають корозію; 2) замінюють повітря (О2) на гелій або інший інертний газ, чи просто створюють вакуум; 3) додають різні інгібітори корозії; 4) створюють захисні плівки (оксидні, масляні, металічні або лакові); 5) вводять у метал компоненти, що підвищують його корозійну стійкість; 6) застосовують протекторний або катодний захист.
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гальванічні елементи. Корозія металів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов