рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Загальні властивості металів
Реферат Курсовая Конспект
Загальні властивості металів
Загальні властивості металів - раздел Химия, ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ Переважній Більшості Елементів Періодичної Системи (Понад 80%) У Вільному Ста...
Переважній більшості елементів Періодичної системи (понад 80%) у вільному стані відповідають прості речовини метали. До елементів, які існують у вигляді простих речовин-металів, належать s-елементи І і II груп (окрім Гідрогену), усі d- і f-елементи, а також р-елементи головних підгруп: ІІІ (крім В), ІV (Ge, Sn, Pb), V (Sb, Bi) і VI ( Po) груп. Деяким елементам (Германій, Стибій, Силіцій) відповідають прості речовини, що поєднують металічні властивості з неметалічними.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і значно рідше 3 або 4 електрони та великі атомні радіуси.
Метали визначаються здатністю їхніх атомів легко віддавати свої зовнішні (валентні) електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від'ємною) спорідненістю до електрона.
Прості речовини метали. За звичайних умов це тверді речовини кристалічної будови (крім ртуті) з металічним типом зв'язку. Для них характерні: особливий металічний блиск; висока тепло- та електропровідність; пластична деформація. Кристалічні гратки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 1.1).

Рис. 1.1. Схематичне зображення металічних граток
Більшість металів кристалізується в одному з трьох типів кристалічної гратки (рис.1.2): щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni, γ-Fe), кубічна об’ємноцентрована (лужні метали, Cr, V, Pb, W, α-Fe).

Рис. 1.2. Кристалічні гратки металів: а- кубічна гранецентрована;
б- гексагональна; в - кубічна об’ємноцентрована
Хімічні властивості металів. В хімічних процесах атоми металів можуть тільки віддавати електрони, виконуючи відновлювальну функцію: Meo – nе → Men+
Метали як відновники, взаємодіють з окисниками: неметалами (киснем, галогенами, сіркою, азотом, фосфором), водою, кислотами, солями, інколи лугами. Лужні та лужноземельні метали взаємодіють також з воднем:

Відновлювальна здатність різних металів не однакова. Для реакцій в водних розчинах вона визначається положенням металу в електрохімічному ряді напруг (величиною електродного потенціалу).
При зануренні металічної пластинки у розчин, який має однойменні іони металу, на межі поділу метал – розчин встановлюється рівновага
 ,
,
виникає подвійний електричний шар, різниця потенціалів в якому і називається електродним потенціалом. Абсолютне значення електродного потенціалу виміряти експериментально або розрахувати теоретично неможливо, тому визначають його відносну величину за допомогою електрода порівняння (водневого, каломельного тощо) чи обчислюють за рівнянням Нернста:
 (1)
(1)
де  - стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
- стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
Для водневого електрода 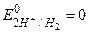 (прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
(прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
 (2)
(2)
Концентрація іонів металу обчислюється за рівнянням:
[Men+]=С∙ z∙ a
де С – молярна концентрація розчину; z - число іонів металу, що утворюються із однієї молекули електроліту; a - ступінь дисоціації, в частках одиниці.
Значення стандартних електродних потенціалів відносно водневого електрода визначені при 298 К (25ºС) і зведені в таблиці електродних потенціалів (див. Додаток, с.22). Для будь-якої іншої концентрації електроліту електродний потенціал розраховується за рівняннями (1),(2).
Приклад 1. Обчислити потенціал мідного електрода, якщо концентрація CuSO4 – 0,5 моль/л (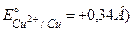 .
.
Розв’язання. Для електродної реакції Cu2++2е-=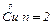 .
.
Концентрація іонів металу [Cu2+]=0,5 моль/л. Тому
 В.
В.
Розмістивши метали у порядку зростання значень їхніх стандартних електродних потенціалів (Додаток, с.22), одержують ряд стандартних електродних потенціалів (електрохімічний ряд напруг металів):
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H2,
– Конец работы –
Эта тема принадлежит разделу:
ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Загальні властивості металів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов