рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Задачи для самостоятельного решения
Реферат Курсовая Конспект
Задачи для самостоятельного решения
Задачи для самостоятельного решения - раздел Химия, СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ 1. Выпадет Ли Осадок Srso4, Если К 0,01 М Раствору Srcl2...
1. Выпадет ли осадок SrSO4, если к 0,01 М раствору SrCl2 прибавить равный объем насыщенного раствора сульфата кальция? ПР(CaSO4) = 4,9 .10-5, ПР(SrSO4) = 3,4 . 10-7. Ответ: ПКИ = 1,75×10-5 (да).
2. Выпадет ли осадок Mg(OH)2, если к 20 мл 0,2 М раствора MgCl2 прибавить 10 мл 2 М раствора NH4OH и 10 мл 1 М раствора NH4Cl? Kд(NH4OH) = 1,76 . 10-5, pK = 4,76; ПР(Mg(OH)2)=6.10-12. Ответ: ПКИ = 1,3×10-10 (да)
3. Рассчитать молярную растворимость BaSO4 в воде и сравнить ее с растворимостью в растворе, 1 л которого содержит 13,2 г сульфата аммония. ПР(BaSO4) = 1,1 . 10-10. Ответ: S1 = 1,05×10-5 моль/л; S2 = 1,1×10-9 моль/л; S1/S2 ~ 104
4. Рассчитать молярную растворимость AgCl в 1М растворе аммиака. ПР(AgCl)=1,78 . 10-10. b([Ag(NH3)2]+)=1,7 . 107. Ответ: S = 4,1×10-2 моль/л
5. Выпадет ли осадок CdS из 1 л раствора, содержащего 0,1 моль CdSO4 и 0,5 моль KCN, если к нему добавить сульфидный ион до концентрации 5×10-3 моль/л? ПР(CdS)=1,6 . 10-28. b([Cd(CN)4]+2=1017. Ответ: ПКИ = 5×10-17 (да).
6. При каком значении рН начнется образование осадка Cu(OH)2 из 0,001 М раствора [Cu(NH3)4]2+, если избыточная концентрация аммиака равна 0,1 моль/л? ПР(Cu(OH)2) =8,3 . 10-20. b([Cu(NH3)4]2+)=1,07 . 1012. Ответ: рН = 9,7
7. При каком значении рН начнется образование осадка CoS (a), если 0,001 М раствор CoCl2 насыщать сероводородом? В 100 г воды в стандартных условиях растворяется 3 г сероводорода. Плотность раствора равна единице (1г/мл). Значение общей константы диссоциации H2S Кд = К1.К2 = 8,9.10-22, ПР(CoS)=1,8 . 10-20. Ответ: рН = 1,7
6. ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) МЕТОД АНАЛИЗА
6.1 Общая характеристика метода
Сущность метода заключается в измерении объема раствора реагента R (титранта), израсходованного на реакцию с определяемым веществом X:
X + R = Р
Аналитическим сигналом выступает объем титранта V(R).
Особенности метода заключаются в следующем:
1. Концентрация титранта должна быть точно известна (с точностью до 4 значащих цифр). Такой раствор называется стандартным, титрованным. Например. С(НС1) = 0,1070 моль/л, C(1/2Н2SO4) = 0,08732 моль/л.
2. Раствор реагента прибавляют до тех пор, пока не будет достигнуто эквивалентное соотношение между X и R. Этот момент называется точкой эквивалентности (т. э.) или стехиометричности.
Таким образом, в отличие от гравиметрического метода анализа, в титриметрическом методе используют эквивалентное количество реагента (без избытка).
Основной операцией метода является титрование. При этом раствор реагента (титрант, рабочий раствор, титрующий раствор) помещают в бюретку и постепенно приливают к раствору определяемого вещества. Момент окончания реакции между X и R фиксируют визуально по заметному аналитическому эффекту (изменение, появление или исчезновение окраски, выпадение или растворение осадка).
Следует различать истинную т. э. - момент титрования, когда количества вещества эквивалента X и R. равны, и конечную точку титрования (к. т. т.), которую фиксируют на практике. В идеале они должны совпадать, однако на практике это бывает редко.
Преимущества метода:
а) быстрота и простота выполнения анализа (требуется несколько минут; всего одна операция в отличие от гравиметрии); б) простота оборудования; в) высокая точность (0,5 %);
г) возможность использования реакций разного типа (кислотно-основных, окислительно-восстановительных, осаждения и комплексообразования), д) низкая стоимость.
Недостаток метода. Точность ниже, чем точность гравиметрического метода анализа, т. к. точность измерения объема всегда ниже точности взвешивания на аналитических весах.
Области применения. Титриметрический метод анализа используется чаще, чем гравиметрический, т. к. в нем применяются реакция всех типов. Это один из наиболее важных методов количественного анализа, поскольку он пригоден для анализа органических и неорганических веществ, водных и неводных растворов.
Чувствительность метода. При объеме пробы 100 мл можно определить в ней 10-3 г вещества (10-4 моль/л).
Точность метода составляет 0,5 % и зависит от точности определения концентрации рабочего раствора (должно быть 4 значащие цифры) и точности измерения объема (необходимо пользоваться точной мерной посудой).
Общая схема титриметрического анализа:
1) взятие и растворение навески;
2) приготовление растворов и установление их концентрации (стандартизация растворов);
3) создание условий протекания реакции (температура, рН, концентрация веществ, ионная сила, катализатор);
4) титрование;
5) расчет результатов анализа.
Основные приемы титриметрического анализа:
1) прямое титрование;
2) обратное титрование (титрование по остатку);
3) титрование по замещению.
1. В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Типичным примером прямого титрования является титрование щелочи кислотой. В общем виде его можного выразить уравнением:
В + Т = ВТ
Расчет результата прямого титрования основан на законе эквивалентов:
CВ · VВ = CТ · VТ,
где CВ и VВ - нормальная концентрация и объем раствора определяемого вещества, CТ и VТ, - нормальная концентрация и объем раствора титранта израсходованный на титрование. Концентрация определяемого вещества будет равна:
CВ = CТ . VТ/VВ.
2. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, используют прием обратного титрования: добавляют к определяемому веществу заведомый избыток титранта Т(1), доводят реакцию до конца, а затем находят количество непрореагировавшего титранта титрованием его другим реагентом Т(2) с концентрацией СТ2. Процесс можно выразить двумя уравнениями:
В + Т(1)(избыток) = ВТ(1) + Т(1)(остаток)
Т(1)(остаток) + Т(2) = Т(1)Т(2)
Очевидно, что на определяемое вещество затрачивается количество титранта Т(1), равное разности nэкв.(В) = CТ1 · VТ1 - CТ2 · VТ2.
Концентрация определяемого вещества рассчитывается по формуле:
Сэкв.(В) = (CТ1 . VТ1 - CТ2 . VТ2)/СВ.
3. Титрование заместителя можно применять в тех же случаях, когда реакция прямого титрования не удовлетворяет выше указанным требованиям. Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом. Процесс можно выразить двумя уравнениями:
В + Т(1)(избыток) = ВТ(1) + Т(1)(остаток)
ВТ(1)+ Т(2) = ВТ(1)Т(2)
Расчет концентрации определяемого вещества осуществляется аналогично прямому титрованию, так как количество эквивалентов вещества В равно количеству эквивалентов вещества ВТ(1) и Т(2):
CВ = CТ2 . VТ2/VВ.
6.2 Растворы в титриметрическом анализе
Все растворы, которые применяются в титриметрическом анализе, делятся на стандартные, или титрованные, и вспомогательные.
Стандартные растворы готовят с использованием аналитических весов и точной мерной посуды (бюретки, пипетки, мерные колбы). Концентрацию их записывают с точностью до 4 значащих цифр.
Вспомогательные растворы готовят с использованием технических весов и неточной мерной посуды (мерные цилиндры, мерные пробирки, мензурки). Концентрацию их записывают с точностью менее 4 значащих цифр.
Типы стандартных растворов и способы их приготовления:
На схеме представлена классификация стандартных растворов и указаны все возможные способы их приготовления
| Стандартные растворы | |
| Первичные (приготовленные) | Вторичные (установленные) |
| Из кристаллического исходного вещества | Из кристаллического вещества |
| Из фиксанала | Из более концентрированного раствора |
Первичный стандартный раствор готовят растворением точного количества чистого вещества известного состава в определенном объеме растворителя. Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле:
m(X) = Cэкв.(Х) · V(X) · Mэкв.(Х) , где m(X) - масса навески, Cэкв. - молярная концентрация эквивалентов (или нормальная концентрация) вещества Х, V(X) - объем приготавливаемого раствора, Mэкв.(Х) - молярная масса эквивалентов вещества титранта Х.
Например, необходимо приготовить 100 мл (0,1л) 0,05н. раствора К2Сr2О7 для титрования в кислой среде (fэкв. - 1/6). Следовательно, надо взять навеску вещества
m(K2Cr2O7) = C(l/6 K2Cr2O7) · V(K2Cr2O7) · М(1 /6 К2Сг2O7) = 0,05 · 0,1 · (294,185/6) = 0,2452 г.
После взвешивания навески и растворения ее в мерной колбе точную концентрацию приготовленного раствора рассчитывают но формуле: Сэкв. (Х) = m (X) / Mэкв.(X) · V (X)
Вторичный стандартный раствор.
Сначала готовят раствор с примерно известной концентрацией, затем определяют его точную концентрацию (стандартизируют) по подходящему первичному стандарту. Концентрационные характеристики вторичных стандартов всегда содержат большую погрешность, чем характеристики первичных стандартов.
Кристаллическое вещество для приготовления первичного стандартного раствора называется исходным (установочным) веществом или первичным стандартом. К нему предъявляются следующие требования:
а) состав должен строго соответствовать формуле; б) оно должно быть устойчиво на воздухе (не должно окисляться, поглощать СО2, Н2О) при хранении в твердом состоянии и в растворе; в) должно быть хорошо растворимым, нелетучим, желательно безводным; г) должно быть чистым (квалификации не ниже «х. ч.» или «ч. д. а»); д) должно легко очищаться от примесей перекристаллизацией; е) должно иметь большую молярную массу эквивалента (тогда ошибка при взятии навески будет меньше); ж) должно быть доступным и недорогим.
Если взять вещество, удовлетворяющее этим требованиям, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.
Фиксаналы (стандарт-титры). Это точно отвешенные массы твердых, веществ «х. ч.» или точно отмеренные объемы их растворов, помещенные в запаянные стеклянные ампулы. Содержимое ампулы переносят в мерную колбу, разбавляют: до метки и получают раствор с точно известной концентрацией. Применение фиксаналов значительно сокращает время на приготовление стандартных растворов.
Требования к стандартным растворам. Они должны быть устойчивы. Их концентрация не должна меняться во времени, поэтому при хранении иногда принимают специальные меры. Так, если раствор поглощает СО2, то его закрывают пробкой с поглотительной трубкой, в которую помещают натронную известь (NaOH и СаО). Если раствор разлагается на свету, то его хранят в темной бутыли.
6.3 Решение типовых задач
Задача (приготовление растворов).
1. Сколько грамм КОН необходимо взять чтобы приготовить 250 мл 0,1 н раствора?
Решение: фактор эквивалентности гидроксида калия в ионообменных реакциях равен единице, поэтому молярная масса равна молярной массе эквивалентов, а нормальность раствора равна молярности. Так как молярная и нормальная концентрации выражаются в моль/л, то объём раствора выразим в литрах
V = 0,25л. Концентрация раствора равна:
СМ = Сэкв. = n/V; число молей экв.: n= m/M, тогда: C = m/(V·M) , а
m = C · V · M = 0,1моль/л · 0,25л · 56г/моль = 1,4 г.
2. Сколько грамм 100%-ной фосфорной кислоты надо взять, чтобы приготовить 100 мл 0,3 н раствора этой кислоты? Чему равна молярная концентрация этого раствора?
Решение:
Фосфорная кислота Н3РО4 - трехосновная кислота содержит три атома водорода, которые в реакциях ионного обмена могут быть замещены другими катионами, значит фактор эквивалентности fэкв.(Н3РО4) = 1/3, а молярная масса эквивалента Мэкв = М . fэкв., тогда Сэкв. = nэкв./V =m(Н3РО4)/V Mэкв.=  m(Н3РО4)/(V . М(Н3РО4) . fэкв.)=
m(Н3РО4)/(V . М(Н3РО4) . fэкв.)= 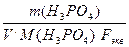
, откуда m(Н3РО4) = Сэкв. . V . М(Н3РО4) . fэкв. = 0,3 моль экв/л . 0,1 л . 98 г/моль . 1/3экв.-1. = 0,98 г.
Молярная и нормальная концентрации связаны соотношением:
СМ = Сэкв. . fэкв = 0,3 . 1/3 = 0,1 моль/л. Ответ: масса фосфорной кислоты 0,98 г; молярная концентрация 0,1 моль/л.
3. Какой объем раствора НСl с массовой долей растворенного вещества 16,5% и плотностью ρ=1,08 г/мл необходимо взять для получения 500 мл 0,1 М НСl?
Решение: Находим массу НСl, содержащуюся в 500 мл 0,1 М раствора НСl, причем, объём раствора выражаем в литрах, так как молярная концентрация выражается в г/л: m(НСl)= С(НСl) . V(НСl) . M(НСl) = 0,1моль/л . 0,5л . 36,5г/моль = 1,82 г (НСl). Далее находим объём исходного раствора, зная, что m(НСl) = w(НСl) . m(исх.р-ра), причем, w(НСl) выражаем в долях единицы (16,5% = 0,165):
V(исх.) = m(исх.р-ра)/ρ = m(НСl)/(w(НСl) . ρ) = 1,82г /( 0,165 . 1,08г/мл) = 10,21мл. Ответ: 10,21мл 16,5% раствора.
4. Сколько грамм 100% серной кислоты необходимо взять, чтобы получить 500 мл раствора, рН которого будет равен 2?
Решение:
Запишем уравнение диссоциации серной кислоты:
H2SO4 = 2H+ + SO42-, откуда следует, что fэкв.(H2SO4) = 1/2; Мэкв. (H2SO4)= М (H2SO4) . fэкв.(H2SO4) = 98 . 1/2 =49 г/моль экв.
рН = -lg[H+]; [H+] =Сэкв.(Н+)= СМ (Н+) =10-pH = 10-2 =0,01моль/л. По закону эквивалентов Сэкв.(Н+)=Сэкв.(Н2SО4), тогда
m(Н2SО4) = Сэкв.(Н2SО4) . V . Мэкв.(Н2SО4) = 0,01 моль экв/л . 0,5 л . 49 г/моль. = 0,245 г.
– Конец работы –
Эта тема принадлежит разделу:
СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Факультет экологической медицины... Кафедра биохимии и биофизики...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Задачи для самостоятельного решения
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов