Решение типовых задач - раздел Химия, СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ 1. А) Определить Молярную Массу Эквивалента Na3Po4 При ...
1. а) Определить молярную массу эквивалента Na3PO4 при титровании стандартным раствором HCl с индикатором метиловым оранжевым.
б) Определить молярную концентрацию эквивалента титруемого раствора Na3PO4 , если на титрование 100 мл этого раствора понадобилось 300 мл 0,1 М раствора НСl.
Решение:
а) При титровании соли Na3PO4 раствором НСl в присутствии метилового оранжевого протекает реакция:
Na3PO4 + 2НСl = NaH2PO4 + 2NaCl
Как можно видеть, 1 моль Na3PO4 соответствует 2 ионам водорода в данной реакции, следовательно, 1/2 Na3PO4 - условная частица, химически эквивалентна одному иону Н+, следовательно, fэкв.( Na3PO4) = 1/2, а молярная масса эквивалента Na3PO4 равна: М(1/2 Na3PO4 ) = Мэкв.( Na3PO4 ) =
М( Na3PO4 ) . fэкв.( Na3PO4 ) = 163,941 . 1/2 = 81,971 г/моль экв.
б) Молярная концентрация соляной кислоты равна нормальной, так как молекула НСl содержит один ион водорода и фактор эквивалентности в реакциях ионного обменя для нее равен единице. Мэкв.(НСl) = М(НСl), Сэкв.(НСl) = СМ(НСl). По закону эквивалентов:
nэкв.( Na3PO4 ) = nэкв.(HCl) или для растворов реагирующих веществ: Сэкв.( Na3PO4 ) . V( Na3PO4 ) = Cэкв. (HCl) . V(HCl), откуда: Сэкв.( Na3PO4 ) = Сэкв.(НСl) . V(HCl)/V( Na3PO4 ) = 300 . 0,1/100 = 0,3 моль экв/л. Ответ: 0,3 моль экв./л.
2. На реакцию смеси, состоящей из карбонатов натрия и калия, массой 0,4000 г израсходовали 22,00 мл 0,3000 М раствора НCl. Вычислить массовую долю (%) карбоната натрия и карбоната калия в смеси.
Решение: Согласно уравнению
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
одному молю водорода соответствует условная частица 1/2(Na2CO3), т.е. fэкв.(Na2CO3) = 1/2.
В точке эквивалентности (т.э.)
n(Na2CO3) + n(K2CO3) = n(HCl),
где n(HCl) = C(HCl) . V(HCl)/1000 - число молей HCl, затраченное на титрование.
Если через х обозначить массовую долю (%) Na2CO3 в смеси, то число молей эквивалентов К2CO3 и Na2CO3 , содержащееся в навеске равно:
n(1/2Na2CO3) =m(смеси) . х /(Мэкв.(Na2CO3) . 100);
n(1/2K2CO3) = m(смеси) . (100 - х) /(Мэкв.(К2CO3) . 100).
Сочетание этих соотношений дает:
m(смеси) . х /(Мэкв.(Na2CO3) . 100) + m(смеси) . (100 - х) /(Мэкв.(К2CO3) . 100) = C(HCl) . V(HCl)/1000.
Подставляя числовые значения, получаем:
0,4000 . х/(52,9942 . 100) + 0,4000 . (100 - х)/(69,103 . 100) = 0,3000 . 22,00/1000;
х = 46,12% Na2CO3; 100 - 46,12 = 53,88% К2CO3.
3. Рассчитайте процентное содержание поваренной соли в пищевом продукте, если на титрование водной вытяжки, полученной при настаивании 100 мл воды с 2,72 г продукта, израсходовано 7,50 мл 0,051N раствора AgNO3.
Решение:
Уравнение реакции метода осадительного титрования:
NaCl + AgNO3 = NaNO3 + AgCl (осадок);
процентное содержание (массовая доля) равно:
W = m(NaCl) . 100%/m(продукта); m(NaCl) рассчитаем по результатам осадительного титрования используя закон эквивалентов и учитывая, что фактор эквивалентности хлористого натрия и азотнокислого серебра равен единице, а это означает, что величины молярных концентраций растворов этих веществ равны нормальным концентрациям: С(NaCl)=С(AgNO3) . V(AgNO3) / V(NaCl);
m(NaCl) = С(NaCl) . V(NaCl) . M(NaCl) = С(AgNO3) . V(AgNO3) . V(NaCl) . M(NaCl) / V(NaCl) = С(AgNO3) . V(AgNO3) . M(NaCl) ;
W = 100% . С(AgNO3) . V(AgNO3) . M(NaCl)/m(продукта) = 100% . (0,051моль/л . 0,0075л . 58,5г/моль)/2,72г = 0,82%. Ответ 0,82%.
4. Для титрования навески образца гидроксида натрия (NaOH) массой 0.1281г, содержащего некоторое количество карбоната натрия (Na2CO3) в качестве примеси, было израсходовано при использовании фенолфталеина в качестве индикатора 23,90 мл 0,1295 М НСl. Рассчитайте массовую долю карбоната натрия в данном образце, если для титрования такой же его навески с метиловым оранжевым было израсходовано 24,40 мл этого же раствора НСl.
Решение.
При титровании данной смеси с фенолфталеином протекают реакции: NaOH + HCl = NaCl + H2O; Na2CO3 + HCl = NaHCO3 + NaCl. При использовании метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до угольной кислоты. Разность между объемами раствора титранта, израсходованного для титрования в присутствии метилового оранжевого и фенолфталеина, соответствует реакции: NaHCO3 + HCl = H2CO3 + NaCl. Фактор эквивалентности гидрокарбоната натрия (NaHCO3) в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то количество молей гидрокарбоната натрия равно первоначальному количеству молей карбоната натрия и по результатам двух титрований: n(NaHCO3) = nо(Na2CO3) = С(HCl) . (Vмо(HCl) - Vф(HCl)) 10-3, где Vмо(HCl) и Vф(HCl) - объемы соляной кислоты, использованной для титрования с метиловым оранжевым и фенолфталеином соответственно; w (Na2CO3) = m (Na2CO3)/mнавески = n(Na2CO3) . M(Na2CO3) . 100% /mнавески. Подставив вместо n(Na2CO3) его выражение через концентрацию и объемы использованной для титрования соляной кислоты, получим: w(Na2CO3) = С(HCl). (Vмо(HCl) - Vф(HCl)) . 10-3 . M(Na2CO3) /mнавески = 0,1295 . (24,40 - 23,90) . 10-3 . 105,989 . 100%/0,1281 = 5,36%.
5. Вывести формулу для расчета рН в точке эквивалентности при титровании слабой кислоты сильным основанием.
Решение.
В т.э. в растворе находится соль, образованная слабой кислотой и сильным основанием, которая подвергается гидролизу. В ионном виде уравнение гидролиза аниона слабой кислоты: А- + Н2О = НА + ОН-
Выражение для константы гидролиза:
Кг= 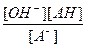 ; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =
; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =  pKг -
pKг -  lg[A-]
lg[A-]
Очевидно, что концентрация аниона слабой кислоты будет равна концентрации образовавшейся соли, которая полностью диссоциировала в растворе, за вычетом той части анионов, которая подверглась гидролизу: [A-] = Ссоли – [HA]. Так как количество анионов, подвергшегося гидролизу невелико, можно в разности пренебречь величиной [НА] и тогда [A-] = Ссоли; тогда рОН =  pKг -
pKг -  lgСсоли. Так как Кг = Кводы/Кдисс. =
lgСсоли. Так как Кг = Кводы/Кдисс. =
10-14/Кдисс., то рОН = 7 -  pKд -
pKд -  lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -
lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -  pKд -
pKд -  lgСсоли) = 7 +
lgСсоли) = 7 +  pKдисс. +
pKдисс. +  lgСсоли.
lgСсоли.
6. На титрование 100 мл смеси соляной и фосфорной кислоты 0,1 н раствором гидроксида натрия с использованием в качестве индикатора метилового оранжевого (рТ = 4,0) потребовалось 200 мл раствора титранта. На титрование такого же количества смеси тем же титрантом с использованием в качестве индикатора фенолфталеина (рТ = 9,0) потребовалось 300 мл раствора титранта. Определить молярные концентрации соляной и фосфорной кислот в смеси.
Решение.
Уравнения реакций титрования c метиловым оранжевым:
HCl + NaOH = NaCl + H2O
H3PO4 + NaOH = NaH2PO4 + H2O
Уравнения реакций титрования c фенолфталеином:
HCl + NaOH = NaCl + H2O
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Соляная кислота – сильная кислота и, поэтому оттитровывается полностью в обоих вариантах. Фосфорная кислота – слабая кислота и, поэтому при использовании метилового оранжевого (кислая среда) оттитровывается по первой стадии (с образованием дигидрофосфата натрия), а с фенолфталеином (основная среда) – по двум стадиям (с образованием гидрофосфата натрия).
Соляная кислота – одноосновная кислота, поэтому ее молярная концентрация в растворе равна нормальной концентрации. Фосфорная кислота в первом случае реагирует как одноосновная, поэтому ее молярная концентрация равна нормальной, а во втором случае как двухосновная, поэтому ее нормальная концентрация в два раза больше молярной (число эквивалентности равно двум).
Используем закон эквивалентов для составления двух алгебраических уравнений соответствующих двум вариантам титрований:
Nэкв. (NaOH) = nэкв. (HCl) + nэкв. (H3PO4) или для растворов реагирующих веществ
Cэкв. (NaOH) ּV (NaOH) = [Cэкв. (HCl) + Cэкв. (H3PO4)] ּV (HCl+H3PO4)
Пусть х – молярная концентрация (равная нормальной) соляной кислоты в смеси, а y – молярная концентрация фосфорной кислоты. Тогда Cэкв. (H3PO4) = у в первом случае и Cэкв. (H3PO4) = 2у – во втором. Уравнения закона эквивалентов первого (1) и второго (2) вариантов титрования:
Cэкв. (NaOH) ּV1 (NaOH) = (x + y) ּV (HCl+H3PO4) (1)
Cэкв. (NaOH) ּV2 (NaOH) = (x + 2y) ּV (HCl+H3PO4) (2)
Подставим соответствующие значения объемов и концентраций:
0,1 ּ 200 = (х + у) ּ 100 (1)
0,1 ּ 300 = (х + 2у) ּ 100 (2)
Сократив оба уравнения на 100, вычтем из второго уравнения первое и получим у = 0,1.
х = 0,2 – у = 0,1.
Ответ: СМ (HCl) = CМ (H3PO4)] = 0,1 моль/л
Все темы данного раздела:
СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Минск
УДК 543(075.8)
ББК 24.4
Рецензенты:
Рекомендовано к изданию НМС МГЭУ им. А. Д. Сахарова
(протокол № 7 от 2
Пырко А. Н.
Сборник задач и контрольные задания по аналитической химии / А. Н. Пырко. Мн. 2010. 140 с.
Сборник включает теоретические сведения основ аналитической химии
ЗАКОН ЭКВИВАЛЕНТОВ
Все расчеты в химии вообще и в аналитической в частности основаны на законе эквивалентов: Вещества реагируют между собой в эквивалентных количествах.
Эквивалент - это реальная или у
Способы выражения концентрации растворов
Все расчеты в аналитической химии осуществляются с использованием различных выражений концентраций веществ. Определение количества вещества в растворе – это определение его концентрации в данном ра
Связь различных способов выражения концентрации растворов
Очевидно, что значение концентрации растворенного вещества в данном растворе зависит от способа ее выражения, причем, существует определенная зависимость величин концентраций. Например, если концен
Ионная сила и рН растворов
Большинство аналитических определений осуществляется в растворах, поэтому необходимо знать их основные свойства. Важным свойством раствора является его ионная сила, которая определяется как полусум
Расчет рН растворов разных электролитов
При определении концентрации кислот и оснований важное значение имеет расчет рН растворов. Можно выделить несколько видов кислотно-основных растворов: сильной кислоты или основания, слабой кислоты
Решение типовых задач
1. Определить число эквивалентности гидроксида кальция z1 и дигидрофосфата алюминия z2 в реакции: 9 Ca(OH)2 + 2Al(H2PO4)3 = 2Al(OH)
Задачи для самостоятельного решения
1. К 100 мл 0,1 М раствора серной кислоты прибавили 100 мл 0,4 н раствора гидроксида натрия. Определить рН полученного раствора?
Ответ: рН = 13.
2. К 100 мл 0,2 н
ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ) МЕТОД АНАЛИЗА
Гравиметрический метод количественного анализа основан на точном измерении массы определяемого компонента, выделенного в свободном состоянии или в виде соединения определенного состава. Это ме
Общая характеристика метода
Гравиметрический метод широко используется для анализа различных объектов с высоким содержанием определяемого компонента. Достоинства метода: а) высокая точность (относительная погрешность
Решение типовых задач
1. При какой концентрации цианид-ионов кадмий (II) количественно осадится в виде Cd(CN)2? Решение:
равновесие Cd(CN)2 = Cd2+ + 2CN- характеризуе
Задачи для самостоятельного решения
1. Выпадет ли осадок SrSO4, если к 0,01 М раствору SrCl2 прибавить равный объем насыщенного раствора сульфата кальция? ПР(CaSO4) = 4,9 .10-5,
Задачи для самостоятельного решения
1. Сколько грамм NaОН необходимо взять чтобы приготовить 250 мл 0,1 н раствора?
Ответ: 2,0 г.
2. Сколько грамм 90%-ной серной кислоты надо взять, чтобы приготовить
Реакции в титриметрическом анализе
Реакции, лежащие в основе титриметрических методов, должны удовлетворять ряду требований. Главными из них являются следующие: 1) реакция должна протекать с большой скоростью, иначе нельзя
Расчет концентрации веществ на различных участках кривых титрования
I. До начала титрования. В растворе находится определяемое вещество X с исходной концентрацией Со. 2. До т. э. количество неоттитрованного вещества X рассчитывают следующим образом: nэ
Общая характеристика метода
В основе метода лежит реакция передачи протона от титранта к определяемому веществу или наоборот: НА + В → НВ+ + А- кислота основание сопряженная кислота со
Правильно подобранным является индикатор, интервал перехода окраски которого, полностью входит в границы скачка на построенной кривой титрования
Ошибка титрования.
При титровании слабой кислоты может возникнуть гидроксидная (рТ > рН т.э.) или кислотная, обусловленная наличием в растворе неоттитрованной кислоты (рТ < рН
Выбор индикатора титрования
1-я т. э. соответствует рН = 4,5. В этой области лежит интервал перехода метилового оранжевого (DрН = 3,5 - 4,5). 2-я т. э. соответствует рН = 9,21. В этой области происходит изменение окр
Задачи для самостоятельного решения
1 Рассчитать рН и степень диссоциации 0,1 М раствора HNO2. Как изменятся эти величины при добавлении к раствору нитрита калия до концентрации 0,5 моль/л? Kд(HN
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Общая характеристика методов Методы окислительно-восстановительного титрования основаны на использовании окислительно-восстановительных реакций (ОВР). Аналитические возможности методов позв
Перманганатометрия
Основой метода являются реакции окисления восстановителей раствором КМnО4 Основные химические полуреакции: а) в кислой среде (рН<4): МnО4- + 8H
Условия проведения и аналитические возможности метода
Титрование проводят при пониженной или при комнатной температуре, так как при нагревании улетучивается иод, уменьшается чувствительность индикаторной реакции. Титрование проводят в
Задачи для самостоятельного решения
1. Определить фактор эквивалентности и молярную массу эквивалента окислителя и восстановителя в реакции:
а) I2 + 2S2O32- = 2I
Общая характеристика метода
Метод является областью метода комплексометрии и основан на реакции образования прочных комплексов ионов металлов с комплексонами (комплексонатов). Комплексоны это полиаминополикарбоновые кисло
Кривые комплексонометрии и способы установления конечной точки титрования (к. т. т.)
При построении кривых титрования используют понятия условных констант устойчивости комплексонатов, условных концентраций определяемого металла и лиганда. Необходимость в этом обусловлена тем, что т
Условия проведения комплексонометрического титрования
1. Необходимо создать оптимальное значение рН. Нижняя граница оптимального для титрования значения рН определяется тем значением рН, при котором комплексонат еще достаточно устойчив. Верхняя границ
Решение типовых задач
1. Определить молярную концентрацию, рабочего раствора ЭДТА (комплексона III), если на титрование навески металлического цинка массой 0,0131 г, растворенного предварительно в кислоте, затратили 18,
Задачи для самостоятельного решения
1. Рассчитать равновесную концентрацию ионов кадмия в 0,1 М растворе [Cd(NH3)4]2+. β([Cd(NH3)4]2+ = 4 . 106
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Электрохимические методы анализа основаны на изучении и использовании окислительно-восстановительных процессов, протекающих на поверхности электрода или в приэлектродном слое раствора электролит
Основные электрохимические методы
Потенциометрия. В потенциометрических методах измеряется разность потенциалов между индикаторным электродом и электродом сравнения в отсутствие тока в электрохимической цепи. В этих условиях
Решение типовых задач
1. Элемент состоит из водородного электрода, опущенного в кровь и каломельного электрода насыщенного раствором KCl, потенциал которо- го равен 0,25В. Определить рН и [Н+] крови п
Задачи для самостоятельного решения
1 Рассчитать окислительно-восстановительный потенциал системы Ag+/Ag0 в 0,1 М растворе AgNO3. Как изменится потенциал при прибавлении к раствору эквивалентного коли
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
Хроматография – это способ разделения смеси веществ на отдельные компоненты, основанный на явлении адсорбции и десорбции вещества на поверхности разделяющей подвижную и неподвижную фазы.
СПЕКТРОСКОПИЯ
Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом, т.е. на определении характеристик поглощаемого, испускаемого или рассеянного излучения.
Поглощение в УФ- и видимой областях
Спектры поглощения в УФ- и видимой областях содержат как качественную, так и количественную информацию о поглощающем веществе. Последнее и позволяет использовать их в аналитической химии. Поглощени
Люминесценция
Поглотив квант энергии электромагнитного излучения частица вещества переходит из основного, самого нижнего по энергии (S0) электронного состояния, в более высокое по энер
Инфракрасная (ИК) спектроскопия
Спектры поглощения в видимой и УФ-областях, о которых шла речь выше, возникают в результате электронных переходов в атомах и молекулах. Поглощение же в ИК-области обусловлено переходами между колеб
Ядерный магнитный резонанс (ЯМР)
Метод ЯМР основан на резонансном поглощении электромагнитной энергии, обусловленном магнетизмом ядер. Это поглощение наблюдается в сильном магнитном поле, под действием которого энергетические уров
Масс-спектрометрия (МС)
Масс-спектрометрия – один из наиболее эффективных и широко применяющихся аналитических методов. Его отличают высокая селективность, чувствительность и точность.
Принцип метода состоит в то
Химические сенсоры
Химические сенсоры являются удобным аналитическим инструментом, который представляет интерес для исследователей и практиков. Постоянное развитие исследований приводит к созданию новых сенсоров, рас
Решение типовых задач
1. Рассчитать молярную концентрацию тирозина в растворе, если известно, что плотность поглощения (D) электромагнитного излучения с длиной волны λмакс. = 275 нм такого раствора в кюв
Задачи для самостоятельного решения
1. Комплекс катиона алюминия с индикатором комплексонометрического титрования ксиленовым оранжевым имеет максимум в спектре поглощения в водном растворе при λмакс. = 540 нм. Определ
АНАЛИТИЧЕСКАЯ ПРОБА
Первой стадией методики анализа является отбор пробы. Погрешность, возникающую на стадии пробоотбора, часто вносят основной вклад в погрешность результата анализа.Аналитическая про
Отбор проб веществ разного агрегатного состояния
Газы: Используют вакуумные мерные колбы или бюретки с соответствующей запорной жидкостью а также контейнеры, а также контейнеры специальные, представляющие собой сосуды из нержавеющей стали, стекла
Получение лабораторной пробы
Генеральную пробу подвергают усреднению, которое подразумевает гомогенизацию и сокращение. Метод сокращения массы пробы - «квартование». Пробу высыпают на поверхность квадрата и делят по диагонали
Разложение пробы
Пробу необходимо перевести в физическую и химическую форму, приемлемую для анализа. Способы разложения пробы зависят от химического состава образца, природы определяемого образца, цели анализа и ис
Дополнение
Основные математические формулы, знание которых необходимо для решения задач по аналитической химии:
рХ = -lgX, при этом Х = 10-рХ = 10lgX; логарифм ч
Л И Т Е Р А Т У Р А
1. Васильев В.П. Аналитическая химия. Т.1. Титриметические и гравиметрический методы анализа. Москва: Дрофа, 2005. – 366 С.
2. Васильев В.П. Аналитическая химия. Т.2. Физико-химические мет
Стандартные электродные потенциалы окислительно-восстановительных систем
окисленная форма
количество электронов
восстановленная форма
Е0, В
F2
Константы устойчивости комплексных соединений
Комплексное
соединение
β
lgβ
Комплексное
соединение
β
lgβ
Аналитическая химия
(Вопросы к сдаче зачета)
1. Аналитическая химия (аналитика) и химический анализ. Классификация методов аналитической химии. Понятие о химических, физически
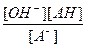 ; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =
; так как [ОН-]= [АН] , то [ОН-]2 = Кг . [А-] , прологарифмируем это выражение : lg[OH-]2 =2 . lg[OH-] = Kг . [A-], тогда рОН = - lg[OH-] =  pKг -
pKг -  lg[A-]
lg[A-] pKг -
pKг -  lgСсоли. Так как Кг = Кводы/Кдисс. =
lgСсоли. Так как Кг = Кводы/Кдисс. = pKд -
pKд -  lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -
lgСсоли. В тоже время рН = 14 – рОН = 14 – (7 -  pKд -
pKд -  lgСсоли) = 7 +
lgСсоли) = 7 +  pKдисс. +
pKдисс. +  lgСсоли.
lgСсоли.






Новости и инфо для студентов