Правильно подобранным является индикатор, интервал перехода окраски которого, полностью входит в границы скачка на построенной кривой титрования - раздел Химия, СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ Ошибка Титрования.
При Титровании Слабой Кислоты Может Возникнуть Ги...
Ошибка титрования.
При титровании слабой кислоты может возникнуть гидроксидная (рТ > рН т.э.) или кислотная, обусловленная наличием в растворе неоттитрованной кислоты (рТ < рН т.э.).
Гидроксидная ошибка в процентах к исходному количеству кислоты или щелочи (относительная ошибка) составляет:
δОН- = 2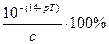 .
.
Кислотная ошибка в процентах к исходному количеству кислоты (относительная ошибка) рассчитывается по формуле:
δНА = 10рК – рТ . 100% .
7.5 Титрование смеси кислот (оснований)
Раздельное титрование смеси кислот (оснований) возможно, если значения их констант диссоциации различаются более чем в 104 раз. Поскольку скачок на кривой титрования наблюдается, если Kдиc. титруемых кислот (оснований) >10-7, то для раздельного определения смеси кислот (оснований) необходимо, чтобы соблюдались следующие условия:
К1/К2>104; К1, К2>10-7
Кривая титрования имеет свои особенности:
а) скачок титрования сильной кислоты заметно уменьшен, так как в 1-й т. э. сильная кислота оттитрована полностью. рН определяется присутствием неоттитрованной слабой кислоты и рассчитывается по формуле:
рН= 0,5pKк - 0,5 lgCк =  рКк +
рКк +  рСк =
рСк =  (-lgKк - lgCk)= -
(-lgKк - lgCk)= - lg Ka. Ck = -(lg
lg Ka. Ck = -(lg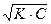 )
)
Чем меньше константа диссоциации и концентрация слабой кислоты, тем резче скачок титрования вблизи 1-й т. э.;
б) после 1-й т. э. наблюдается более плавное изменение pН, так как в растворе присутствует буферная система (слабая кислота и ее соль).
Значение рН во 2-й т. ч. определяется гидролизом соли слабой кислоты:
Выбор индикатора проводят исходя из значений рН в т. э.
Титрование многоосновных кислот
Диссоциация многоосновных кислот протекает ступенчато, причем каждая из ступеней характеризуется своей константой диссоциации. Например, при титровании кислоты Н2А с погрешностью не более 0,1%, в зависимости от соотношения констант диссоциации кислоты по ступеням, возможны 2 варианта.
1. Если отношение констант диссоциации К1/К2> 104 , то титрование идет последовательно (ступенчато). Сначала практически полностью оттитровывается кислота по 1-й ступени, а затем по 2-й. В
этом случае на кривой титрования наблюдается два скачка, т. е. двухосновная кислота выступает как смесь двух одноосновных кислот
(например, H2SO3).
2. Если отношение констант диссоциации K1/K2< 104 двухосновная кислота титруется одновременно по двум ступеням и на кривой титрования наблюдается один скачок, соответствующий суммарному титрованию кислоты по 1-й и 2-й ступеням диссоциации (например, Н2С2О4).
Рассмотрим расчет кривой титрования миогоосновной кислоты сильным основанием на примере Н3РО4.
Н3РО4 является трехосновной кислотой, диссоциирует по 3 ступеням, каждая из которых характеризуется следующими константами диссоциации:
Н3РО4, + NaOH = NaH2PO4 + H2O К1 =7,1 . 10-3
NaH2PO4 + NaOH = Na2HPO4 + H2O K2 =6,2 . 10-8
Na2HPO4 + NaOH = Na3PO4 + Н2О K3 = 5,0 . 10-13.
Отношение K1/K2 ~ 105 и K2/K3 105 но K3 < 10-8, поэтому на кривой титрования наблюдается только два скачка, несмотря на то, что H3PO4 является трехосновной кислотой. Первый скачок соответствует оттитровыванию кислоты по 1-й ступени, а второй скачок - по 2-й ступени.
7.6 Расчет рН раствора в различные моменты титрования
1) до начала титрования.. В растворе находится H3РO4 в исходной концентрации. рН определяется диссоциацией Н3РО4. Поскольку К1>К2>К3, то можно пренебречь диссоциацией кислоты по 2-й и 3-й степеням и рассматривать H3PO4 как одноосновную кислоту. рН рассчитывается по формуле:
рН =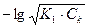 = 0,5 рК1 - 0,5 lgCk =
= 0,5 рК1 - 0,5 lgCk =  рК1 -
рК1 -  lgCk
lgCk
2) до 1-ой т.э. В растворе находятся неоттитрованная. Н3PO4, ее соль NaH2PO4 и Н2О. рН определяется присутствием буферной системы - слабой кислоты и ее соли: pH = pK1 - lg(Ck/Ccоли)
3) 1-я т. э. В растворе находится соль слабой кислоты NaН2PO4, являющаяся амфолитом. рН определяется по формуле pH = 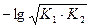 = 0,5pK1 + 0,5pK2 =
= 0,5pK1 + 0,5pK2 =  pK1 +
pK1 +  pK2
pK2
4) до 2-й т.э. В растворе находятся 2 соли фосфорной кислоты различной степени замещенности (NaH2PO4 и Na2НPO4), т. е. буферная система. Расчет рН ведут по формуле:
pН = рК2 - 1g [NaH2PO4]/[Na2HPO4];
5) 2-я т.э. В растворе находится соль Na2НPO4, являющаяся амфолитом. рН определяется по формуле:
pH = 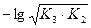 = 0,5pK2 + 0,5pK3;
= 0,5pK2 + 0,5pK3;
6) до 3-й т. э. В растворе находятся 2 соли различной степени замещенности (Na2HPO4 и Na3PO4), т. е. буферная система. Расчет рН ведут по формуле:
pН = рК3 - lg [Na2HPO4]/[Na3PO4];
7) 3-я т. э. В растворе находится соль Na3PO4. pН раствора определяется гидролизом этой соли и рассчитывается по формуле:
pH = 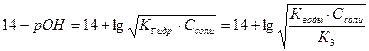 = 7 + 0,5pK3 + 0,5 . lgCcоли
= 7 + 0,5pK3 + 0,5 . lgCcоли
8) после 3-й т.э. В растворе находятся соль Na3PO4 и избыток NaOH, который подавляет гидролиз соли. рН определяется избытком титранта и рассчитывается по формуле pH=14 + lg[OH-].
Все темы данного раздела:
СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Минск
УДК 543(075.8)
ББК 24.4
Рецензенты:
Рекомендовано к изданию НМС МГЭУ им. А. Д. Сахарова
(протокол № 7 от 2
Пырко А. Н.
Сборник задач и контрольные задания по аналитической химии / А. Н. Пырко. Мн. 2010. 140 с.
Сборник включает теоретические сведения основ аналитической химии
ЗАКОН ЭКВИВАЛЕНТОВ
Все расчеты в химии вообще и в аналитической в частности основаны на законе эквивалентов: Вещества реагируют между собой в эквивалентных количествах.
Эквивалент - это реальная или у
Способы выражения концентрации растворов
Все расчеты в аналитической химии осуществляются с использованием различных выражений концентраций веществ. Определение количества вещества в растворе – это определение его концентрации в данном ра
Связь различных способов выражения концентрации растворов
Очевидно, что значение концентрации растворенного вещества в данном растворе зависит от способа ее выражения, причем, существует определенная зависимость величин концентраций. Например, если концен
Ионная сила и рН растворов
Большинство аналитических определений осуществляется в растворах, поэтому необходимо знать их основные свойства. Важным свойством раствора является его ионная сила, которая определяется как полусум
Расчет рН растворов разных электролитов
При определении концентрации кислот и оснований важное значение имеет расчет рН растворов. Можно выделить несколько видов кислотно-основных растворов: сильной кислоты или основания, слабой кислоты
Решение типовых задач
1. Определить число эквивалентности гидроксида кальция z1 и дигидрофосфата алюминия z2 в реакции: 9 Ca(OH)2 + 2Al(H2PO4)3 = 2Al(OH)
Задачи для самостоятельного решения
1. К 100 мл 0,1 М раствора серной кислоты прибавили 100 мл 0,4 н раствора гидроксида натрия. Определить рН полученного раствора?
Ответ: рН = 13.
2. К 100 мл 0,2 н
ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ) МЕТОД АНАЛИЗА
Гравиметрический метод количественного анализа основан на точном измерении массы определяемого компонента, выделенного в свободном состоянии или в виде соединения определенного состава. Это ме
Общая характеристика метода
Гравиметрический метод широко используется для анализа различных объектов с высоким содержанием определяемого компонента. Достоинства метода: а) высокая точность (относительная погрешность
Решение типовых задач
1. При какой концентрации цианид-ионов кадмий (II) количественно осадится в виде Cd(CN)2? Решение:
равновесие Cd(CN)2 = Cd2+ + 2CN- характеризуе
Задачи для самостоятельного решения
1. Выпадет ли осадок SrSO4, если к 0,01 М раствору SrCl2 прибавить равный объем насыщенного раствора сульфата кальция? ПР(CaSO4) = 4,9 .10-5,
Задачи для самостоятельного решения
1. Сколько грамм NaОН необходимо взять чтобы приготовить 250 мл 0,1 н раствора?
Ответ: 2,0 г.
2. Сколько грамм 90%-ной серной кислоты надо взять, чтобы приготовить
Реакции в титриметрическом анализе
Реакции, лежащие в основе титриметрических методов, должны удовлетворять ряду требований. Главными из них являются следующие: 1) реакция должна протекать с большой скоростью, иначе нельзя
Расчет концентрации веществ на различных участках кривых титрования
I. До начала титрования. В растворе находится определяемое вещество X с исходной концентрацией Со. 2. До т. э. количество неоттитрованного вещества X рассчитывают следующим образом: nэ
Общая характеристика метода
В основе метода лежит реакция передачи протона от титранта к определяемому веществу или наоборот: НА + В → НВ+ + А- кислота основание сопряженная кислота со
Выбор индикатора титрования
1-я т. э. соответствует рН = 4,5. В этой области лежит интервал перехода метилового оранжевого (DрН = 3,5 - 4,5). 2-я т. э. соответствует рН = 9,21. В этой области происходит изменение окр
Решение типовых задач
1. а) Определить молярную массу эквивалента Na3PO4 при титровании стандартным раствором HCl с индикатором метиловым оранжевым.
б) Определить молярную концентрацию экв
Задачи для самостоятельного решения
1 Рассчитать рН и степень диссоциации 0,1 М раствора HNO2. Как изменятся эти величины при добавлении к раствору нитрита калия до концентрации 0,5 моль/л? Kд(HN
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Общая характеристика методов Методы окислительно-восстановительного титрования основаны на использовании окислительно-восстановительных реакций (ОВР). Аналитические возможности методов позв
Перманганатометрия
Основой метода являются реакции окисления восстановителей раствором КМnО4 Основные химические полуреакции: а) в кислой среде (рН<4): МnО4- + 8H
Условия проведения и аналитические возможности метода
Титрование проводят при пониженной или при комнатной температуре, так как при нагревании улетучивается иод, уменьшается чувствительность индикаторной реакции. Титрование проводят в
Задачи для самостоятельного решения
1. Определить фактор эквивалентности и молярную массу эквивалента окислителя и восстановителя в реакции:
а) I2 + 2S2O32- = 2I
Общая характеристика метода
Метод является областью метода комплексометрии и основан на реакции образования прочных комплексов ионов металлов с комплексонами (комплексонатов). Комплексоны это полиаминополикарбоновые кисло
Кривые комплексонометрии и способы установления конечной точки титрования (к. т. т.)
При построении кривых титрования используют понятия условных констант устойчивости комплексонатов, условных концентраций определяемого металла и лиганда. Необходимость в этом обусловлена тем, что т
Условия проведения комплексонометрического титрования
1. Необходимо создать оптимальное значение рН. Нижняя граница оптимального для титрования значения рН определяется тем значением рН, при котором комплексонат еще достаточно устойчив. Верхняя границ
Решение типовых задач
1. Определить молярную концентрацию, рабочего раствора ЭДТА (комплексона III), если на титрование навески металлического цинка массой 0,0131 г, растворенного предварительно в кислоте, затратили 18,
Задачи для самостоятельного решения
1. Рассчитать равновесную концентрацию ионов кадмия в 0,1 М растворе [Cd(NH3)4]2+. β([Cd(NH3)4]2+ = 4 . 106
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Электрохимические методы анализа основаны на изучении и использовании окислительно-восстановительных процессов, протекающих на поверхности электрода или в приэлектродном слое раствора электролит
Основные электрохимические методы
Потенциометрия. В потенциометрических методах измеряется разность потенциалов между индикаторным электродом и электродом сравнения в отсутствие тока в электрохимической цепи. В этих условиях
Решение типовых задач
1. Элемент состоит из водородного электрода, опущенного в кровь и каломельного электрода насыщенного раствором KCl, потенциал которо- го равен 0,25В. Определить рН и [Н+] крови п
Задачи для самостоятельного решения
1 Рассчитать окислительно-восстановительный потенциал системы Ag+/Ag0 в 0,1 М растворе AgNO3. Как изменится потенциал при прибавлении к раствору эквивалентного коли
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
Хроматография – это способ разделения смеси веществ на отдельные компоненты, основанный на явлении адсорбции и десорбции вещества на поверхности разделяющей подвижную и неподвижную фазы.
СПЕКТРОСКОПИЯ
Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом, т.е. на определении характеристик поглощаемого, испускаемого или рассеянного излучения.
Поглощение в УФ- и видимой областях
Спектры поглощения в УФ- и видимой областях содержат как качественную, так и количественную информацию о поглощающем веществе. Последнее и позволяет использовать их в аналитической химии. Поглощени
Люминесценция
Поглотив квант энергии электромагнитного излучения частица вещества переходит из основного, самого нижнего по энергии (S0) электронного состояния, в более высокое по энер
Инфракрасная (ИК) спектроскопия
Спектры поглощения в видимой и УФ-областях, о которых шла речь выше, возникают в результате электронных переходов в атомах и молекулах. Поглощение же в ИК-области обусловлено переходами между колеб
Ядерный магнитный резонанс (ЯМР)
Метод ЯМР основан на резонансном поглощении электромагнитной энергии, обусловленном магнетизмом ядер. Это поглощение наблюдается в сильном магнитном поле, под действием которого энергетические уров
Масс-спектрометрия (МС)
Масс-спектрометрия – один из наиболее эффективных и широко применяющихся аналитических методов. Его отличают высокая селективность, чувствительность и точность.
Принцип метода состоит в то
Химические сенсоры
Химические сенсоры являются удобным аналитическим инструментом, который представляет интерес для исследователей и практиков. Постоянное развитие исследований приводит к созданию новых сенсоров, рас
Решение типовых задач
1. Рассчитать молярную концентрацию тирозина в растворе, если известно, что плотность поглощения (D) электромагнитного излучения с длиной волны λмакс. = 275 нм такого раствора в кюв
Задачи для самостоятельного решения
1. Комплекс катиона алюминия с индикатором комплексонометрического титрования ксиленовым оранжевым имеет максимум в спектре поглощения в водном растворе при λмакс. = 540 нм. Определ
АНАЛИТИЧЕСКАЯ ПРОБА
Первой стадией методики анализа является отбор пробы. Погрешность, возникающую на стадии пробоотбора, часто вносят основной вклад в погрешность результата анализа.Аналитическая про
Отбор проб веществ разного агрегатного состояния
Газы: Используют вакуумные мерные колбы или бюретки с соответствующей запорной жидкостью а также контейнеры, а также контейнеры специальные, представляющие собой сосуды из нержавеющей стали, стекла
Получение лабораторной пробы
Генеральную пробу подвергают усреднению, которое подразумевает гомогенизацию и сокращение. Метод сокращения массы пробы - «квартование». Пробу высыпают на поверхность квадрата и делят по диагонали
Разложение пробы
Пробу необходимо перевести в физическую и химическую форму, приемлемую для анализа. Способы разложения пробы зависят от химического состава образца, природы определяемого образца, цели анализа и ис
Дополнение
Основные математические формулы, знание которых необходимо для решения задач по аналитической химии:
рХ = -lgX, при этом Х = 10-рХ = 10lgX; логарифм ч
Л И Т Е Р А Т У Р А
1. Васильев В.П. Аналитическая химия. Т.1. Титриметические и гравиметрический методы анализа. Москва: Дрофа, 2005. – 366 С.
2. Васильев В.П. Аналитическая химия. Т.2. Физико-химические мет
Стандартные электродные потенциалы окислительно-восстановительных систем
окисленная форма
количество электронов
восстановленная форма
Е0, В
F2
Константы устойчивости комплексных соединений
Комплексное
соединение
β
lgβ
Комплексное
соединение
β
lgβ
Аналитическая химия
(Вопросы к сдаче зачета)
1. Аналитическая химия (аналитика) и химический анализ. Классификация методов аналитической химии. Понятие о химических, физически
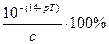 .
. рКк +
рКк +  рСк =
рСк =  (-lgKк - lgCk)= -
(-lgKк - lgCk)= - lg Ka. Ck = -(lg
lg Ka. Ck = -(lg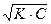 )
) 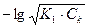 = 0,5 рК1 - 0,5 lgCk =
= 0,5 рК1 - 0,5 lgCk =  рК1 -
рК1 -  lgCk
lgCk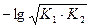 = 0,5pK1 + 0,5pK2 =
= 0,5pK1 + 0,5pK2 =  pK1 +
pK1 +  pK2
pK2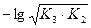 = 0,5pK2 + 0,5pK3;
= 0,5pK2 + 0,5pK3;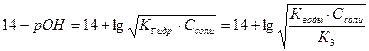 = 7 + 0,5pK3 + 0,5 . lgCcоли
= 7 + 0,5pK3 + 0,5 . lgCcоли






Новости и инфо для студентов