рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Реферат Курсовая Конспект
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ - раздел Химия, СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ Общая Характеристика Методов Методы Окислительно-Восстановительного Т...
Общая характеристика методов
Методы окислительно-восстановительного титрования основаны на использовании окислительно-восстановительных реакций (ОВР). Аналитические возможности методов позволяют проводить определение окислителей, восстановителей и веществ, которые сами не проявляют окислительно-восстановительных свойств, но реагируют с окислителями и восстановителями с образованием осадков или комплексных соединений.
Рабочими растворами служат растворы окислителей (окислительное титрование) и восстановителей (восстановительное титрование). Поскольку рабочие растворы восстановителей неустойчивы из-за окисления на воздухе, то восстановительное титрование используют реже. В большинстве случаев готовят рабочие растворы с концентрацией 0,05 моль экв/ л. Почти все они являются вторичными стандартами.
Аналитические характеристики методов близки к характеристикам кислотно-основного титрования, но на анализ часто затрачивается больше времени из-за меньших скоростей окислительно-восстановительных реакций.
Классификация методов основана на применяемых рабочих растворах. Например, перманганатометрия (КМnО4), иодометрия (I2), дихроматометрия (K2Cr2O7), броматометрия (КВгОз) и т. д.
Требования к окислительно-восстановительным рeакциям (ОВР) в титриметрии
Известно более 100 тыс. ОВР. по далеко не все из них подходят для титрования из-за своих особенностей:
а) ОВР это наиболее сложный по механизму тип химических реакций;
б) они не всегда протекают в точном соответствии с суммарным уравнением реакции; в) часто образуются нестойкие промежуточные соединения.
Поэтому ОВР, которая используется для титрования, должна отвечать всем требованиям, обязательным для реакций в титриметрии, а именно:
1) она должна протекать в соответствии со стехиометрическим уравнением реакции. Многие ОВР идут нестехиометрично. Например, реакция
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
протекает в соответствии с уравнением только в присутствии H2SO4. Если для создания необходимой среды использовать другие кислоты (НC1,НNO3), то будут протекать побочные реакции;
2) ОВР должна протекать до конца. Если проводить титрование с погрешностью
< 0.1 %, то должно выполняться условие: lgK>3(n1 + n2), где n1 и n2 - число электронов, участвующих в полурeакциях; К константа равновесия ОВР. Константа равновесия ОВР связана со стандартной ЭДС элемента E0 , равной разности стандартных потенциалов окислителя и восстановителя следующим уравнением:
RT. lnK = E0nF,
где n – число электронов передаваемых от восстановителя к окислителю F – постоянная Фарадея, равная 96500 Кл/моль. В стандартных условиях уравнение приобретает вид:
lgK = 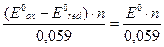
Например, для реакции окисления двухвалентного железа перманганатом калия:
lgK =  тогда К = 1062
тогда К = 1062
Большое числовое значение константы равновесия показывает, что равновесие реакции, протекающей при титровании, практически целиком сдвинуто вправо;
3) она должна идти быстро. Многие ОВР идут медленно, поэтому их нельзя использовать для титрования. Иногда для увеличения скорости нагревают раствор или вводят катализатор.
Способы титрования. Если реакция соответствует всем требованиям и есть возможность зафиксировать к. т. т., то используют прямое титрование. Если реакция идет нестехиометрично, медленно, то применяют обратное титрование и титрование заместителя.
8.1 Расчет фактора и числа эквивалентности веществ, участвующих в ОВР
Обычно необходимо определить, какая доля частицы эквивалентна одному электрону в полуреакции. Например, факторы эквивалентности перманганата и тиосульфата в конкретных реакциях равны:
МnО4- + 8Н+ + 5е- = Мn2+ + Н2О; fэкв.(KMnO4) =1/5, z = 5
МnО4- + 4Н+ + Зе- =МnО2 +2Н2О; fэкв.(KMnO4) = 1/3, z = 3
МnО4-+е- = МnО42-; fэкв.(КМnО4) = 1, z = 1
2S2О3 -2e- = S4O62- ; fэкв.(S2O3-2) = 1, z = 1.
Однако встречаются и более сложные случаи расчета fэкв. вещества, участвующего в ОВР, если проводят титрование по остатку, титрование заместителя, многостадийный анализ или титрование с участием органического вещества. В этих случаях проще всего рассчитать fэкв. определяемого вещества по пропорции, исходя из стехиометрии реакции и fэкв. наиболее «надежного» вещества, участвующего в ней. Если анализ многостадийный, то подобный расчет начинают с последней реакции, поскольку именно она проводится при титровании.
8.2 Кривые окислительно-восстановительного титрования
Кривые метода строятся в системе координат "потенциал - объем титранта (степень оттитрованности)" и имеют S-образный вид. Если титруют раствором окислителя, то получается восходящая кривая, если раствором восстановителя - нисходящая.
Расчет потенциала на различных этапах титрования проводят следующим образом.
1. До начала титрования потенциал рассчитать невозможно, так как в растворе еще нет окислительно-восстановительной пары, поэтому нельзя применить уравнение Нернста.
2. До т.э. потенциал Е рассчитывают по уравнению Нернста для окислительно-восстановительной пары определяемого вещества, так как оно находится в избытке и имеется некоторое количество как окисленной, так и восстановленной формы: Е = Е0 + (0,059/n1) . lg ([Ox]/[Red]), где Е0 это стандартный электродный потенциал пары окисленной и восстановленной формы титруемого вещества n1 - количество электронов переходящее от восстановленной к окисленной форме определяемого вещества, lg [Ox]/[Red]) - логарифм отношения концентраций окисленной и восстановленной форм этого вещества. Например при титровании сульфата железа (II) раствором перманганата калия (рис.6) потенциал до т.э. рассчитывается для полурекции: Fe2+ - e- = Fe3+
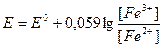 .
.
3. В т.э. потенциал рассчитывают по формуле: Е =(n1 . E01 + n2 . E02)/(n1 + n2), где E01 и E02 - стандартные электродные потенциалы пар окислителя и восстановителя реакции титрования, а n1 и n2 - число электронов в полуреакциях.
Если в реакции участвуют ионы Н+, то расчет ведут по формуле: Е =(n1. E01 + n2 . E02)/(n1 + n2) + 0,059/(n1 + n2) . lg [H+]m, где m - стехиометрический коэффициент при Н+ в суммарном уравнении реакции.
4. После т. э. потенциал рассчитывают по уравнению Hepнста для той окислительно-восстановительной пары, в состав которой входит титрант, так как она находится в избытке и в растворе имеется некоторое количество как окисленной, так и восстановленной формы. Например, для полуреакции:
МnО4- +8Н+ + 5е- = Мn2+ + 4Н2О потенциал рассчитывается по формуле:
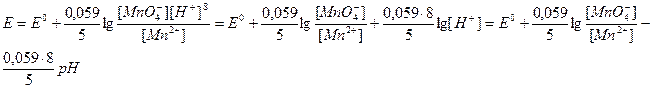 В таблице 3. приведены данные изменения окислительно-восстановительного потенциала при титровании 100 мл 0,1 н раствора FeSO4 0,1 н раствором KMnO4 при С(Н+) = 1 моль/л
В таблице 3. приведены данные изменения окислительно-восстановительного потенциала при титровании 100 мл 0,1 н раствора FeSO4 0,1 н раствором KMnO4 при С(Н+) = 1 моль/л
Таблица 3. Данные изменения окислительно-восстановительного потенциала при титровании 100 мл 0,1 н раствора FeSO4 0,1 н раствором KMnO4 при С(Н+) = 1 моль/л
| Добавле-но 0,1 н KMnO4, V мл | [Fe3+] моль/л | [Fe2+] моль/л | Е, В | Добав-лено 0,1 н KMnO4, V мл | [KMnO4] моль/л | [Mn2+] моль/л | Е, В |
| 1,0 | 10-3 | 0,099 | 0,65 | 100,1 | 2,0 . 10-5 | 0,02 | 1,47 |
| 50,0 | 0,05 | 0,05 | 0,77 | 101,0 | 2,0 . 10-4 | 0,02 | 1,49 |
| 91,0 | 0,091 | 0,009 | 0,83 | 110,0 | 2,0 . 10-3 | 0,02 | 1,50 |
| 99,0 | 0,099 | 10-3 | 0,89 | ||||
| 99,9 | 0,0999 | 10-4 | 0,95 | ||||
| 100,0 | 0,1 | 10-11 | 1,39 |
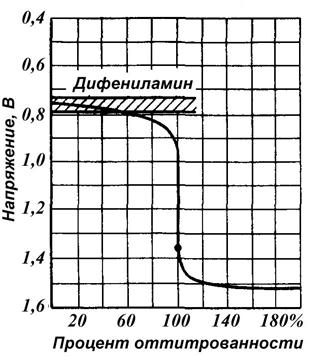
На рис.6 представлена кривая титрования раствора FеSO4 раствором КМnО4 при [H+] = 1 моль/л (pH = 0), определяемая реакцией:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 +8H2O
 _____
_____
Рис.6. Кривая титрования раствора FеSO4 раствором КМnО4
при [H+] = 1 моль/л (pH = 0)
Факторы, влияющие на величину скачка.
Все факторы, влияющие на потенциал, влияют и на величину скачка:
а) природа титруемого вещества и титранта. Чем больше разность стандартных окислительно-восстановительных потенциалов пар титруемого вещества и титранта (DЕ0), тем больше скачок. При малом значении DЕ0 титрование невозможно. Для титрования с погрешностью < 0,1 % надо, чтобы DЕ0 > 0,35 В;
б) рН раствора. Если ионы Н+ или ОН- участвуют в полуреакции, то их концентрация входит и уравнение Нернста в степени, соответствующей стехиометрическому коэффициенту, поэтому величина скачка в таких случаях зависит от значения рН раствора; в) конкурирующие реакции комплексообразования или осаждения с участием окисленной или восстановленной формы. Скачок можно увеличить, если один из компонентов сопряженной окислительно-восстановительной пары связать в комплексное или малорастворимое соединение:
г) концентрация раствора. Если в реакции не участвуют ионы Н+ или ОН- и стехиометрические коэффициенты перед окисленной и восстановленной формами в полуреакции одинаковы, то величина скачка не зависит oт концентраций веществ, поскольку при разбавлении раствора отношение [Ок. формы]/[Вос. формы] останется постоянным. В других случаях разбавление влияет на величину скачка;
д) число электронов, участвующих в полуреакции. Чем больше число электронов, тем больше скачок;
е) температура. Чем больше температура, тем больше Е1 и Е2.
Допущения, которые делают при расчете кривых титрования
Если:
1) стехиометрические коэффициенты при окисленной и восстановленной формах равны;
2) в уравнение Нернста не входят [Н+] или [ОН-] (или они равны 1 моль/л);
3) не учитывается разбавление раствора при титровании,
то можно заменить [Ок. формы]/[Вос. формы] на отношение объемов.
Во всех остальных случаях надо:
а) задать объем реагента;
б) по общим формулам рассчитать молярные концентрации эквивалента неоттитрованного вещества, продуктов реакции, титранта;
в) перевести их в молярные концентрации и подставить в уравнение Нернста.
8.3 Способы фиксирования конечной точки титрования (к. т. т.)
В методах окислительно-восстановительного титрования применяются следующие способы фиксирования к. т. т.
1. Безындикаторное титрование. Применяется, когда окисленная и восстановленная формы рабочего раствора имеют различную окраску. Например. МnО4- (фиолетовый) Мn2+ (бесцветный), I2 (бурый) - I- (бесцветный), В этом случае небольшой избыток титранта после т. э. вызывает появление окраски раствора, и титрование прекращают. Этот способ нельзя использовать при титровании окрашенных растворов.
2. Применение специфических индикаторов. Специфические индикаторы — это вещества, которые образуют интенсивно окрашенные соединения с одним из компонентов окислительно-восстановительной пары. Часто в этой роли могут выступать реактивы для качественных реакций. Например, крахмал является специфическим индикатором на I2 (образуется соединение синего цвета), тиоцианат CNS- — на ионы Fe3+ (комплекс, красного цвета).
3. Применение необратимых индикаторов. Это индикаторы, которые необратимо окисляются или восстанавливаются избытком рабочего раствора в к. т. т. и при этом меняют свою окраску. Например, в броматометрии индикаторы метиловый оранжевый и метиловый красный применяются как необратимые. При титровании раствором КВrO3 образуется Вг2, который окисляет индикаторы с образованием бесцветных продуктов, поэтому в к. т. т. окраска раствора изменяется.
4. Применение окислительно-восстановительных индикаторов. Это органические соединения, которые о6ратимо меняют окраску в зависимости от потенциала системы (дифениламин, антраниловая кислота и др.). Они бывают одно- и двуцветными.
Требования к ним: окраска индикатора должна меняться быстро и обратимо, в узком интервале значений потенциала: окраска окисленной и восстановленной форм индикатора должна быть различной.
Механизм действия: индикатор может обратимо окисляться или восстанавливаться, при этом его окисленная и восстановленная формы имеют различную окраску. При изменении потенциала равновесие смещается в сторону образования той или иной формы индикатора, поэтому окраска раствора изменяется. Окисление или восстановление индикатора могут протекать при участиии и без участия ионов Н+.
Без участия ионов Н+:
окислительно-восстановительное равновесие:
Ind(ок.)+ne 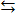 Ind(вос).
Ind(вос).
уравнение Нернста: E = Eo + (0,059/n) · lg[Ind (ox.)]/[Ind(red.)]
интервал перехода индикатора. Если подставить н уравнение Нернста отношение концентраций окисленной и восстановленной форм индикатора, равное 1/10 или 10/1, то после преобразований получим:
E1 = Eo + 0,059/n, E2 = Eo - 0,059/n, ∆EInd = E0 ± 0,059/n, где n - число электронов в реакции перехода окисленной формы индикатора в восстановленную.
Правило выбора окислительно-восстановительного индикатора. Интервал перехода индикатора должен лежать в пределах скачка на кривой титрования (или стандартный потенциал индикатора должен практически совпадать со значением потенциала в т. э.).
Из-за несовпадения стандартного потенциала индикатора со значением потенциала в т.э. возникает индикаторная ошибка титрования. Если при титровании окислителем раствор недотитрован, т.е. Е°Ind.ox /Ind.red < E°т.э. , то относительная ошибка (погрешность) титрования ПT равна:
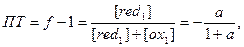 где а =
где а = 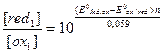 , f = VT /V0 – степень оттитрованности.
, f = VT /V0 – степень оттитрованности.
Если при титровании окислителем раствор перетитрован, т.е. Е°Ind.ox /Ind.red > E°т.э., то относительная ошибка (погрешность) титрования ПT равна:
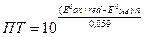 .
.
– Конец работы –
Эта тема принадлежит разделу:
СБОРНИК ЗАДАЧ И КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Факультет экологической медицины... Кафедра биохимии и биофизики...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов