рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- СЛ.1(4) П р и м е р. Реакция синтеза аммиака является обратимой N2 + 3H2 « 2NH3.
Реферат Курсовая Конспект
СЛ.1(4) П р и м е р. Реакция синтеза аммиака является обратимой N2 + 3H2 « 2NH3.
СЛ.1(4) П р и м е р. Реакция синтеза аммиака является обратимой N2 + 3H2 « 2NH3. - раздел Химия, Равновесия в растворах электролитов самостоятельно При 20 Мпа И 400°С Достигается Максимальное И Равное 36 % (По Объему) Содержа...
При 20 МПа и 400°С достигается максимальное и равное 36 % (по объему) содержание NН3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
СЛ.2(0) Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Зависимость между прямой и обратной реакциями количественно выражается через скорость реакции. Скорость химической реакции зависит от числа реагирующих (т. е. соударяющихся) частиц. В первый момент протекания обратимой реакции в системе содержатся только частицы исходных веществ (например, в синтезе аммиака — N2 и Н2). Поэтому в первый момент протекает только прямая реакция, причем с очень высокой скоростью. При появлении частиц конечных веществ (в синтезе аммиака — NН3) развивается обратная реакция, причем вначале с очень малой скоростью.
По мере протекания прямой реакции накапливается все большее число частиц конечных веществ, которые принимают участие в обратной реакции, поэтому скорость обратной реакции все больше возрастает. Одновременно уменьшается число частиц исходных веществ, и скорость прямой реакции все больше уменьшается. СЛ.2(1) В результате в реакционной системе достигается состояние, при котором скорости прямой и обратной реакций равны. Такое состояние реакционной системы называется состоянием химического равновесия. При химическом равновесии обе реакции, прямая и обратная, продолжают протекать, следовательно, это равновесие динамическое (а не статическое), или подвижное.
|
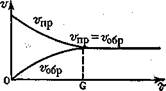
СЛ.2(2) Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия (рис. 1.СЛ.3(0)).
Рис. 1. Изменение во времени скорости прямой и обратной реакций до достижения состояния равновесия.
Соотношение концентраций веществ, участвующих в реакции (реагентов, продуктов), в состоянии равновесия отвечает положению равновесия.
– Конец работы –
Эта тема принадлежит разделу:
Равновесия в растворах электролитов самостоятельно
Обратимые реакции Химическое равновесие... Принцип Ле Шателье Смещение химического равновесия самостоятельно... Вывод формулы константы химического равновесия самостоятельно...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: СЛ.1(4) П р и м е р. Реакция синтеза аммиака является обратимой N2 + 3H2 « 2NH3.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов