рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Равновесия в растворах электролитов
Реферат Курсовая Конспект
Равновесия в растворах электролитов
Равновесия в растворах электролитов - раздел Химия, Равновесия в растворах электролитов самостоятельно При Растворении Электролитв В Происходит Распад Их На Катионы И Анионы (Элект...
При растворении электролитв в происходит распад их на катионы и анионы (электролитическая диссоциация). СЛ.6(0) Если растворяемое вещество — сильный электролит и полностью распадается на ионы, например MA → M+(р)+ A−(р), СЛ.6(1) равновесная концентрация исходного вещества в растворе [MA] = 0, а концентрации катионов и анионов равны концентрации исходного вещества: [M+] = [A−] = c0. СЛ.6(2) В этом случае степень диссоциации (отношение количества вещества, распавшегося на ионы, к исходному количеству вещества) равна: СЛ.6(3):
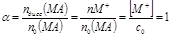
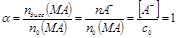
СЛ.7(0) Если в растворе наряду с катионами и анионами присутствуют молекулы растворенного вещества MA → MA(р)+M+(р)+A−(р), СЛ.7(1) равновесные концентрации [MA] > 0, [M+] = [A−] < c0, электролит называют слабым. В этом случае:
СЛ.7(2) 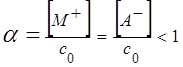
СЛ.7(3) В растворах слабых электролитов существует равновесие MxAy(р)Û xMa+(р)+yAb−(р), СЛ.7(4) которое, согласно закону действующих масс, может быть описано соответствующей константой равновесия, имеющей специальное название — константа диссоциации
СЛ.7(5) 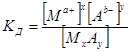
Рассмотрим связь между константой диссоциации и степенью диссоцации слабого электролита. СЛ.8(0) Для простоты рассмотрим электролит, диссоциирующий на один катион и один анион:
MA Û M+ + A−. В этом случае:
СЛ.8(1) 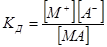
– Конец работы –
Эта тема принадлежит разделу:
Равновесия в растворах электролитов самостоятельно
Обратимые реакции Химическое равновесие... Принцип Ле Шателье Смещение химического равновесия самостоятельно... Вывод формулы константы химического равновесия самостоятельно...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Равновесия в растворах электролитов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов