рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- СЛ.8(2) Исходя из определения степени диссоциации: [M+]=[ A−]=αc0, [MA]= ( 1 − α)c0.
Реферат Курсовая Конспект
СЛ.8(2) Исходя из определения степени диссоциации: [M+]=[ A−]=αc0, [MA]= ( 1 − α)c0.
СЛ.8(2) Исходя из определения степени диссоциации: [M+]=[ A−]=αc0, [MA]= ( 1 − α)c0. - раздел Химия, Равновесия в растворах электролитов самостоятельно Сл.8(3) Подставив Полученные Соотношения В Выражение Для Кон...
СЛ.8(3) Подставив полученные соотношения в выражение для константы диссоциации, получим установленный в 1888 г. закон разбавления Оствальда:
СЛ.8(4) 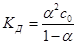 .
.
СЛ.8(5) В случае α << 1 (на практике α<0,05) знаменатель можно приравнять единице, и закон разбавления Оствальда приобретает более простой вид:
СЛ.8(6) 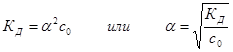
Нетрудно заметить, что при уменьшении концентрации электролита степень диссоциации увеличивается и при «предельном» разбавлении достигает единицы (рис. 2 СЛ. 9(0)). Поэтому при больших разбавлениях пользоваться упрощенной формой закона разбавления Оствальда нельзя.
СЛ. 9(1) В частности, при c → 0 она приводит к α →∞, что лишено смысла. Максимальное значение α=1.
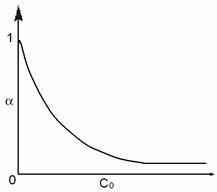
Рис. 2. Зависимость степени диссоциации слабого электролита от его концентрации в растворе
– Конец работы –
Эта тема принадлежит разделу:
Равновесия в растворах электролитов самостоятельно
Обратимые реакции Химическое равновесие... Принцип Ле Шателье Смещение химического равновесия самостоятельно... Вывод формулы константы химического равновесия самостоятельно...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: СЛ.8(2) Исходя из определения степени диссоциации: [M+]=[ A−]=αc0, [MA]= ( 1 − α)c0.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов