Основні теоретичні відомості - раздел Химия, З органічної хімії
Вуглеводні - Речовини, Молекули Яких Складаються З Двох Хіміч...
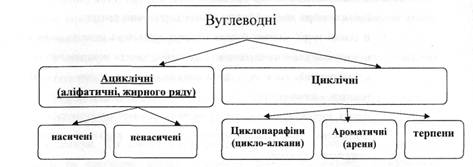
Вуглеводні - речовини, молекули яких складаються з двох хімічних елементів: карбону і гідрогену.
Структуру молекул насичених вуглеводнів та їх ізомерію пояснюють за допомогою теорії хімічної будови органічних сполук О.М. Бутлерова.
Основні положення теорії:
а) показано позитивні та негативні сторони існуючих до нього теорій, що пояснювали будову молекул органічних сполук, - теорії типів і радикалів;
б) підкреслено значення теорії атомності як основи будови молекул кожної органічної речовини;
в) подано визначення поняття хімічної будови органічної сполуки як поширення впливу властивих атомам сил спорідненості валентності, у результаті якої атоми опосередковано або прямо впливають один на одного, сполучаючись у хімічну частинку;
г) сформульовано вісім правил утворення хімічних сполук;
д) вперше звернено увагу на те, що різна реакційна здатність окремих хімічних сполук пояснюється більшою або меншою енергією, за допомогою якої атоми сполучаються у молекули, а також повним або неповним використанням одиниць спорідненості при утворенні зв'язків;
е) сформульовано положення про взаємний вплив атомів і атомних груп у молекулах органічних речовин.
Основні принципи хімічної теорії хімічної будови, органічних сполук О.М. Бутлерова: у молекулах органічних сполук існує певний порядок хімічного зв'язку атомів, що називається хімічною будовою; поняття про хімічну будову веде до припущення про можливість існування речовин, які мають цілком однаковий склад і однакову величину частинок, але зовсім різних між собою внаслідок різної хімічної будови; принцип хімічної будови, який заздалегідь вказує хімічний характер ізомерів повністю пояснює звичайні явища ізомерії складних речовин.
Правила теорії хімічної будови молекул органічних сполук:
1. В основі теорії хімічної будови молекул органічних молекул лежить ідея сталої валентності хімічних елементів. Так, карбон завжди чотиривалентний, гідроген - одновалентний, оксиген - двовалентний, нітроген – три - і п'ятивалентний, галогени - одновалентні.
2. Атоми карбону у молекулах органічних речовин сполучаються між собою за допомогою своїх валентностей, створюючи карбонові ланцюги - прямі, розгалужені, циклічні.
3. Атоми карбону можуть сполучатися між собою у ланцюги і цикли за допомогою інших хімічних елементів - оксигену, нітрогену, сульфуру, фосфору.
4. Атоми карбону можуть витрачати на сполучення між собою по одній, дві, три і чотири валентності, утворюючи прості, подвійні і потрійні зв'язки.
5. Усі чотири валентності атома карбону рівноцінні - однозаміщені найпростіших вуглеводнів (метану, етану, пропану і т.д.) не мають ізомерів.
6. Атоми різних хімічних елементів, що входять до складу молекул органічних сполук , не мають вільних валентностей. Валентності атомів карбону насичені валентностями інших хімічних елементів або насичені між собою з утворенням одинарних, подвійних або потрійних зв'язків.
7. Для кожної речовини існує єдина структурна формула, яка відбиває її основні фізичні й хімічні властивості.
8. Ізомерія органічних сполук, за якої дві і більше органічних сполуки мають однаковий хімічний склад, молекулярну формулу і молекулярну масу, але різні фізичні й хімічні властивості, зумовлена різною хімічною будовою їхніх молекул або просторовим розміщенням у них атомів.
Насичені вуглеводні (алкани) називають за трьома номенклатурами: історичною (тривіальною), раціональною, міжнародною (IUРАС - ІЮПАК) Міжнародна Спілка Теоретичної і Прикладної хімії.
Якщо у якої-небудь молекули алкану відняти один атом гідрогену, то частину молекул з вільною валентністю називають радикалом.
Алкани - (насичені вуглеводні) - найпростіші вуглеводні, у молекулах яких атоми карбону сполучені між собою простими (σ-) зв'язками, а всі інші валентності насичені атомами гідрогену. Електронні орбіталі атомів карбону у молекулах атомів перебувають у стані sp3 - гібридизації.
У молекулі алканів кожний атом карбону сполучений з максимальною кількістю атомів гідрогену, що й дало їм назву „насичені вуглеводні".
Родоначальником алканів є метан СH4. Для членів гомологічного ряду метану існує загальна формула - 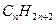 . Починаючи з бутану, члени гомологічного ряду мають ізомери. Для алкенів характерні реакції заміщення (реагують з хлором та бромом на сонячному світлі), нітрування (реакція Коновалова), сульфування, окислення.
. Починаючи з бутану, члени гомологічного ряду мають ізомери. Для алкенів характерні реакції заміщення (реагують з хлором та бромом на сонячному світлі), нітрування (реакція Коновалова), сульфування, окислення.
Алкени (ненасичені вуглеводні етилового ряду або олефіни) містять у складі своєї молекули один подвійний зв'язок. Найпростіший представник алканів - етилен Н2С = СН2. Для молекул алкенів характерна наявність подвійного зв'язку між атомами карбону. Атоми карбону, сполучені між собою подвійним зв'язком, перебувають у стані sp2 - гібридизації. В утворенні такого зв'язку беруть участь одна s - і дві р - орбіталі, що приводять до утворення трьох рівноцінних орбіталей. Подвійний зв'язок - сполучення ковалентних σ - зв'язків і π - зв'язків. У реакціях приєднання кожний sp2 - гібридизований атом карбону стає sp3- гібридизованим:
H2C = CH2 + X2 → H2CX – CH2X
Це призводить до перетворення одного π - зв'язку на два σ - зв'язки.
Ненасичені вуглеводні мають загальну формулу СnН2n. Вони здатні вступати у реакції приєднання гідрогену, галогенів, галогеноводнів (за правилом Марковнікова). Ці сполуки окислюються атомарним киснем, за наявності каталізатора вступають у реакції полімеризації та ізомеризації, горять.
Алкіни — ненасичені вуглеводні ацетиленового ряду мають загальну формулу CnH2n-2. Найпростішим представником є ацетилен НС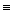 СН. Характерна наявність одного потрійного зв'язку між двома атомами карбону. Потрійний зв'язок є сполученням одного σ - зв'язку і двох π - зв'язків. При цьому атом карбону, що бере участь в утворенні потрійного зв'язку, перебуває у третьому валентному стані — sp - гібридизації. Для алкінів характерні такі типи реакції й електрофільного приєднання АЕ (за σ -зв'язком), електрофільного заміщення SE (за атомом гідрогену кінцевого потрійного зв'язку), утворення ацетиленідів, полімеризації й конденсації з альдегідами і кетонами; нуклеофільного приєднання an (реакції з ціанідною кислотою і спиртами за наявності алкоголятів).
СН. Характерна наявність одного потрійного зв'язку між двома атомами карбону. Потрійний зв'язок є сполученням одного σ - зв'язку і двох π - зв'язків. При цьому атом карбону, що бере участь в утворенні потрійного зв'язку, перебуває у третьому валентному стані — sp - гібридизації. Для алкінів характерні такі типи реакції й електрофільного приєднання АЕ (за σ -зв'язком), електрофільного заміщення SE (за атомом гідрогену кінцевого потрійного зв'язку), утворення ацетиленідів, полімеризації й конденсації з альдегідами і кетонами; нуклеофільного приєднання an (реакції з ціанідною кислотою і спиртами за наявності алкоголятів).
Дієнові вуглеводні (дієни, алкадієни) - насичені вуглеводні з відкритим ланцюгом, у молекулах яких між атомами карбону є два подвійних зв'язки. Загальна формула – CnH2n-2. Розрізняють три групи дієнових вуглеводнів: з кумульованими, ізольованими та спряженою системою подвійних зв'язків.
У молекулі бутадієну - 1,3 (дивініл) СН2 =СН - СН =СН2 атоми карбону перебувають у стані sp - гібридизації. Вони утворюють дев'ять σ - зв'язків, що розміщуються в одній площині, а також два спряжених зв'язки, що лежать у площині, перпендикулярній до σ - зв'язків. Така особливість будови дає можливість приєднувати різні реагенти як до першого й четвертого атомів карбону бутадієну (1,4 - аддукт), так і до першого й другого (1,2- аддукт).
Для дієнів характерні реакції приєднання, окислення, горіння, полімеризації.
Все темы данного раздела:
З органічної хімії
для студентів І і II курсів
напрямів «Екологія» та «Гірництво»
усіх форм навчання
спеціальностей:
ДОСЛІД 1. Добування та властивості метану
Обладнання та реактиви: пробірки, пробка з газовідвідною трубкою, пальник, ексикатор, ацетат натрію, натронне вапно, розчини перманганату калію, розчин йоду з йодидом калію.
ДОСЛІД 2. Добування та властивості етилену.
Обладнання та реактиви: пробірки, пробка з газовідвідною трубкою, штатив, пальник, ексикатор, етиловий спирт, кип'ятильні камінці, H2SO4 (конц.).
У с
ДОСЛІД 2. Добування та властивості етилену.
Обладнання та реактиви: пробірки, пробка з газовідвідною трубкою, штатив, пальник, ексикатор, етиловий спирт, кип'ятильні камінці, H2SO4 (конц.).
У с
ДОСЛІД 3. Добування та властивості ацетилену.
Обладнання та реактиви: пробірки, пробка з газовідвідною трубкою, лінійка, гумова трубка, фільтри, карбід кальцію, розчин йоду у розчині йодиду калію, КМnО4, AgNO3
ВИСНОВОК: Ацетилен утворюється у результаті взаємодії карбіду кальцію з водою.
Молекула ацетилену має потрійний зв'язок. За наявності галогенів зв'язок розривається і відбувається реакція приєднання.
Газовідвідну трубку занурюють у пробірку з 3-5 мл розчину йоду у ро
ВИСНОВОК: Ацетилен утворюється у результаті взаємодії карбіду кальцію з водою.
Молекула ацетилену має потрійний зв'язок. За наявності галогенів зв'язок розривається і відбувається реакція приєднання.
Газовідвідну трубку занурюють у пробірку з 3-5 мл розчину йоду у ро
ВИСНОВОК: Розчин перманганату калію окислює ацетилен у лужному середовищі до оксалатної кислоти.
Атоми гідрогену у молекулі ацетилену вступають у реакцію заміщення на атоми аргентуму.
У пробірку наливають 2-3 мл 1-3 % розчину нітрату аргентуму, додають концентрований в
ТЕМА: Галогенопохідні
Основні теоретичні відомості.
Галогенопохідні вуглеводнів - продукт заміщення одного або кількох атомів гідрогену у молекулах вуглеводнів на атом або атоми
ДОСЛІД 1. Добування йодоформу.
Обладнання та реактиви: пробірки, штативи, пальник, етанол, йод (крист.), дистильована вода, NaOH - 30%.
У пробірку наливають 10-20 крапель етанолу, додають кілька кристал
ДОСЛІД 2. Отримання етилброміду (брометану).
Обладнання та реактиви: пробірки, пробка з газовідвідною трубкою, пальник, етанол, лід, хімічний стакан, бромід калію (кристал.), дистильована вода, H2SO4.
ДОСЛІД 3. Відщеплення галогену дією нітрату срібла у спиртовому розчині.
Обладнання та реактиви: пробірки, штативи, галогенопохідні, нітрат аргентуму (насичений 4% розчин в етиловому спирті).
До 1-2 мл розчину нітрату аргентуму додають 1 краплю
ДОСЛІД 4. Взаємодія хлороформу та чотирьоххлористого вуглецю з лугом.
Обладнання та реактиви: пробірки, штативи, пальник, хімічні стакани, хлороформ, чотирьоххлористий вуглець, розбавлений розчин лугу, нітратної кислоти, розчин нітрату срібла, концен
ТЕМА: Спирти
Основні теоретичні відомості
Спирти (алкоголі) - органічні сполуки, що містять у складі своїх молекул одну або кілька гідроксильних груп -ОН.
Загальна формула нас
ДОСЛІД 2. Утворення діетилового ефіру.
Обладнання та реактиви: пробірки, пальник, етанол, сульфатна кислота (конц.)
Змішують у пробірці 1 мл етанолу та 1 мл концентрованої сульфатної кислоти. Суміш обережно наг
ДОСЛІД 3. Окислення етанолу хромовою сумішшю.
Обладнання та реактиви: пробірки, штативи, пальники, етанол, біхромат калію (5% водний розчин), сульфатна кислота (розбавлена).
Змішують у пробірці 2 мл розчину біхромату
ДОСЛІД 4. Окислення етанолу.
Обладнання та реактиви: пробірки, пальники, пробка з газовідвідною трубкою, етанол, дистильована вода, перманганат калію (крист.), сульфатна кислота (розбавлена), кип'ятильний камі
ДОСЛІД 5. Комплексоутворення багатоатомних спиртів
Обладнання та реактиви: гліцерин, манніт, етанол, етиленгліколь, бура(крист.), пробірки, штативи, розчин сульфату купруму, розчин лугу, фільтр, скляні палички, дистильована вода, х
ТЕМА: Альдегіди та кетони
Основні теоретичні відомості
Альдегіди і кетони (оксосполуки) - похідні вуглеводів, у молекулах яких один або кілька атомів гідрогену заміщені на карбонільну групу
ХІД РОБОТИ
ДОСЛІД 1. Реакція відновлення альдегідами гідроксиду купруму (II).
Обладнання та реактиви: пробірки, пальник 10% розчин їдкого натру, 10% розчин формаліну
ДОСЛІД 2. Відновлення альдегідами сполук срібла (реакція «срібного дзеркала»).
Обладнання та реактиви: пробірки, штативи, 1-2% розчин нітрату аргентуму, 5% розчин аміаку, 11% розчин метаналю.
У пробірку наливають 2-3 мл розчину нітрату аргентуму, дал
ДОСЛІД 3. Добування уротропіну.
Обладнання та реактиви: форфорові чашки, щипці, водяний огрівник, 10% розчин формаліну, 25% розчин аміаку.
У фарфорову чашку вносять 2-3 мл розчину формаліну, додають 4-5
ДОСЛІД 4. Реакції уротропіну.
Обладнання та реактиви: пробірки, штативи, хімічні стакани, пальник, уротропін (крист.), сульфатна кислота (розб.),розчин лугу (конц.), розчин нітрату аргентуму.
I. До 0,2
ДОСЛІД 5. Отримання оксиму ацетону.
Обладнання та реактиви: пробірки, штативи, хімічні стакани, гідроксиламін гідрохлорид, лійка, фільтрувальний папір, ацетон, карбонат натрія (безводні у порошку), льодяна вода, холо
ТЕМА: Карбонові кислоти
Основні теоретичні відомості
Карбонові кислоти - похідні вуглеводнів, у молекулах яких один або кілька атомів гідрогену заміщені карбоксильною групою - СООН.
Формула гомологічного
ДОСЛІД 1. Розчинність у воді карбонових кислот та їх солей.
Обладнання та реактиви: пробірки, пальник, хімічні стакани, різноманітні органічні кислоти (оцтова, стеаринова, трихлороцтова, щавлева, янтарна, молочна, винна, фумарова), розбавле
ДОСЛІД 2. Порівняння ступеня іонізації кислот.
Обладнання та реактиви: органічні кислоти (водні розчини), фенол (6% водний розчин), гліцерин (5-10% водний розчин), індикаторні папірці конго, розбавлена сульфатна (або хлоридна)
ДОСЛІД 3. Витіснення кислот з їх солей іншими кислотами.
Обладнання та реактиви: пробірки, пальник, оцтова кислота (розб.), щавлева кислота (насичена ≈ 8% водний розчин), ацетат натрію (порошок), гідрокарбонат натрію (порошок), янт
ДОСЛІД 4. Різниця в окислюваності органічних кислот.
Обладнання та реактиви:органічні кислоти (мурашина, оцтова, щавлева, винна, фумарова), розбавлена сульфатна кислота, розчин перманганату калію, пробірки, штативи.
Готують
ТЕМА: Властивості похідних карбонових кислот
Основні теоретичні відомості
Естери — продукти заміщення атомів Гідрогену гідроксильної групи карбонових і мінеральних кислот на карбоновий радикал. Розрізняють моно-, ди- і поліест
ДОСЛІД І. Добування етилетаноату (етилацетату).
Обладнання та реактиви: концентрована ацетатна кислота, 80-96 %-етанол, концентрована сульфатна кислота, пробірки, штативи, водяна баня, колби, хімічні стакани.
У пробірку
ДОСЛІД 2. Взаємодія ацетатного ангідриду з водою та спиртом.
Обладнання та реактиви: ацетатний ангідрид, етиловий спирт, хлорид натрію, концентрована сульфатна кислота.
А. У пробірку наливають 1 мл води і 0,5-1 мл ацетатного ангідри
ДОСЛІД 3. Омилення жирів лугом у водному розчині.
Обладнання та реактиви: тваринний жир, 15-20% водний розчин їдкого натру, насичений розчин кухонної солі, пробірки, штативи, водяна баня.
У пробірку вносять 0,5-1 г тварин
ДОСЛІД 4. Розчинність та обмінні реакції мила.
Обладнання та реактиви: мило, сульфат кальцію (насичений 0,2% водний розчин), ацетат плюмбуму (2-3% водний розчин), пробірки, штативи, хімічні стакани.
А. У дві пробірки п
ТЕМА: Властивості моноцукридів.
Основні теоретичні відомості
Вуглеводи, органічні сполуки, молекули яких складаються з трьох хімічних елементів — карбону, гідрогену й оксигену у такому кількісному співвідношенні, що на о
ДОСЛІД 1. Взаємодія вуглеводів з концентрованими кислотами.
Обладнання та реактиви: глюкоза, фруктоза, H2SO4 (конц.), пробірки, штативи.
А. У пробірці розчиняють декілька крупинок будь-якого цукру у 1-2 мл вод
ДОСЛІД 2. Виявлення глюкози реакцією Троммера.
Обладнання та реактиви: 1% розчин глюкози, 10% розчин сульфату купруму (II), 10% розчин гідроксиду натрію.
У пробірку наливають 2-3 мл 1% розчину глюкози, добавляють 3-5 к
ДОСЛІД 3. Відновлення мідно-тартратного комплексу глюкозою (реакція Фелінга).
Обладнання та реактиви: 30% розчин їдкого натру, 2% розчин сульфату купруму, 10% розчин сегнетової солі, 1% розчин глюкози, пробірки, штативи.
У пробірку вносять 1-2 мл 30
ТЕМА: Властивості поліцукридів
Основні теоретичні відомості
Дицукриди - вуглеводи, молекула яких утворена з двох молекул моноцукридів:
C6H12O6 + C6H12
ДОСЛІД 1. Гідроліз (інверсія) цукрози.
Обладнання та реактиви: 10% розчин цукрози, 10% розчин сульфатної кислоти, лакмусовий папірець, 10% розчин їдкого натру, реактиви для реакції Троммера, реактиви для реакції Селіван
ДОСЛІД 2. Реакції крохмалю.
Обладнання та реактиви: крохмаль, етиловий спирт, розчин йоду, розбавлений розчин лугу, розчин сульфату купруму (ІІ), водяна баня, пробірки, штативи.
Біля 1 г крохмалю збо
ДОСЛІД 3. Ступінчастий гідроліз крохмалю.
Обладнання та реактиви: 1% розчин крохмального клейстеру, концентрована хлоридна кислота, реактиви для реакції Троммера, розчин йоду у йодиді калію, водяна баня, пробірки, штативи.
ДОСЛІД 4. Взаємодія целюлози з лугом.
Обладнання та реактиви: фільтрувальний папір, концентрований розчин лугу, розбавлена хлоридна кислота, пробірки, штативи.
Встановлюють у штативі дві пробірки. Одну заповню
До самостійної роботи
1. Що таке поліцукриди?
2. Цукроза - дисахарид. Які моноцукриди входять до складу цукрози?
3. Крохмаль та целюлоза - представники групи полісахаридів. Який характер зв'язування мі

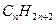 . Починаючи з бутану, члени гомологічного ряду мають ізомери. Для алкенів характерні реакції заміщення (реагують з хлором та бромом на сонячному світлі), нітрування (реакція Коновалова), сульфування, окислення.
. Починаючи з бутану, члени гомологічного ряду мають ізомери. Для алкенів характерні реакції заміщення (реагують з хлором та бромом на сонячному світлі), нітрування (реакція Коновалова), сульфування, окислення. СН. Характерна наявність одного потрійного зв'язку між двома атомами карбону. Потрійний зв'язок є сполученням одного σ - зв'язку і двох π - зв'язків. При цьому атом карбону, що бере участь в утворенні потрійного зв'язку, перебуває у третьому валентному стані — sp - гібридизації. Для алкінів характерні такі типи реакції й електрофільного приєднання АЕ (за σ -зв'язком), електрофільного заміщення SE (за атомом гідрогену кінцевого потрійного зв'язку), утворення ацетиленідів, полімеризації й конденсації з альдегідами і кетонами; нуклеофільного приєднання an (реакції з ціанідною кислотою і спиртами за наявності алкоголятів).
СН. Характерна наявність одного потрійного зв'язку між двома атомами карбону. Потрійний зв'язок є сполученням одного σ - зв'язку і двох π - зв'язків. При цьому атом карбону, що бере участь в утворенні потрійного зв'язку, перебуває у третьому валентному стані — sp - гібридизації. Для алкінів характерні такі типи реакції й електрофільного приєднання АЕ (за σ -зв'язком), електрофільного заміщення SE (за атомом гідрогену кінцевого потрійного зв'язку), утворення ацетиленідів, полімеризації й конденсації з альдегідами і кетонами; нуклеофільного приєднання an (реакції з ціанідною кислотою і спиртами за наявності алкоголятів).






Новости и инфо для студентов