Влияние температуры на скорость химической реакции
ХИМИЧЕСКая кинетика и катализ
1. Классификация химических реакций (самостоятельно).
Скорость химической реакции.
3. Влияние температуры на скорость химической реакции.
Энергия активации.
5. Формула Максвелла – Больцмана (самостоятельно).
6. Катализаторы и каталитические процессы.
Скорость химических реакций.
Под скоростью химической реакции понимается изменение концентрации реагирующих веществ в единицу времени.
 Чтобы вычислить u реакции нужно определить, насколько изменилась концентрация одного из реагирующих веществ в единицу времени (рис. 1 СЛ. 1(0)).
Чтобы вычислить u реакции нужно определить, насколько изменилась концентрация одного из реагирующих веществ в единицу времени (рис. 1 СЛ. 1(0)).
Рис. 1.
СЛ. 1(1) Dt=t2-t1, -DC=C2-C1 Þ u= -DC/Dt
Знак минус говорит о том, что с уменьшением С скорость тоже уменьшается. Если u рассчитывается по одному из продуктов реакции, то u=DC/Dt . Несмотря на знак минус в уравнении u считается положительной величиной.
Более применимое вычисление скорости хим. реакции вытекает из закона действия масс СЛ.2(0).
Согласно этому закону u~ концентрации реагирующих веществ в данный момент времени. СЛ. 2 (1)Для реакции А®В, u может быть выражена следующим кинетически уравнением: u=КСА, где СА - концентрация вещества А в данный момент времени, К - коэффициент пропорциональности - константа u химических реакций.
Сл. 2 (2) При взаимодействии 2х и более веществ mA + nB ®pC + gD, математическое выражение скорости будет: u=KCAmCBn. т.е. u химических реакций прямо пропорциональна произведению реагирующих веществ, стехиометрические коэффициенты входят в уравнения в виде степени при соответствующей концентрации.
Константа u химической реакции не изменяется при изменении концентраций реагирующих веществ. Иногда К называют удельной скоростью реакции, т.е. при СА = СВ = 1, К = u.
Константа скорости зависит от природы реагирующих веществ, t0, присутствия примесей (в том числе катализаторов), от среды в которой протекает реакция.
Чем больше константа скорости, тем быстрее идет реакция.
Обобщая можно сделать следующий вывод:
Скорость химической реакции пропорциональна концентрации реагирующих веществ: СЛ. 3:
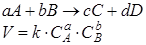
Где:
СА, СВ – молярные концентрации реагентов в любой момент времени моль/л,
a, b – стехиометрические коэффициенты,
а – порядок реакции по веществу А,
b – порядок реакции по веществу В,
а + b –общий кинетический порядок реакции. Общий порядок простой реакции совпадает с ее молекулярностью.
k – константа скорости химической реакции.
3. Влияние t0 на скорость химической реакции Сл 4(0).
Опыт показывает, что с повышением t0 скорость химических реакций возрастает. Сл 4(1)В уравнении химической кинетике u=КCАСВ влияние t0 включает в себя К. С увеличением t0 возрастает К Þ и возрастает u.
Сл 4(2).Если через Кt - конст. при t0 = t0, а Kt+10 при t0=t0+10 его, то отношение величины первой называется температурным коэффициентом скорости реакции (g), g= Kt+10/ Kt.
Сл 4(3).Согласно эмпирическому правилу Вант-Гоффа g колеблется от 2 до 4, т.е. повышая t0 на 100 u возрастает в два- четыре раза.
Сл 4(4).Пример если g = 2, t0 + 1000, то скорость реакции увеличится в 1024 раза, т.е.
Kt+100/ Kt=g10=210=1024.
Обобщение – СЛ.5.
увеличение температуры в арифметической прогрессии, влечет за собой увеличение скорости реакции, в геометрической.
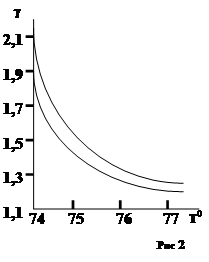 Хотя из правила Вант-Гоффа коэффициент g должен быть постоянным для каждой химической реакции, это справедливо лишь на очень узком интервале температур. При значительных перепадах температуры g значительно уменьшается при увеличении температуры (рис. 2 СЛ. 6).
Хотя из правила Вант-Гоффа коэффициент g должен быть постоянным для каждой химической реакции, это справедливо лишь на очень узком интервале температур. При значительных перепадах температуры g значительно уменьшается при увеличении температуры (рис. 2 СЛ. 6).
Точная зависимость К скорости реакции от t0 была найдена Аррениусом. СЛ.7(0) Уравнение Аррениуса имеет вид: lnK=B - A/T, где К - константа u реакции; А и В - постоянные характерные для данной реакции; Т - температура.
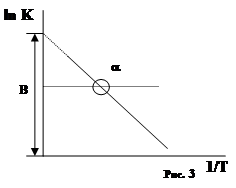 как видно из уравнения lnК обратно пропорционален Т. Коэффициенты А и В находят графически (рис. 3 СЛ.7(1)).
как видно из уравнения lnК обратно пропорционален Т. Коэффициенты А и В находят графически (рис. 3 СЛ.7(1)).
Энергия активации.
Согласно теории активации Аррениуса реакционноспособны только те молекулы, которые обладают запасом Е (избыточной энергией), достаточным для… Рис. 4.Автокатализ.
Рис. 6 Кинетическая кривая продукта автокаталитической реакцииГетерогенный катализ.
1. Диффузия исходных веществ к поверхности катализатора. СЛ.14(2) 2. Адсорбция исходных веществ на поверхности с образованием… А + В + К ® АВКРис. 7. а) Дегидрирование спиртов на дублете; б) Дегидрирование циклогексана на секстете
Теория мультиплетов позволила связать каталитическую активность металлов с величиной их атомного радиуса.
САМОСТОЯТЕЛЬНО
Классификация химических реакций.
Все кинетические реакции различаются по молекулярности и порядку реакций. Молекулярность реакции определяется числом молекул, участвующих в химическом взаимодействии.
По молекулярности все реакции делятся на:
- мономолекулярные - в которых участвуют одна молекула, например: I2Û2I, все реакции изомерного превращения и разложения.
- бимолекулярные: во взаимодействии участвуют две молекулы, пример: H2+I2Û2HI.
- тримолекулярные: при одновременном столкновении 3х молекул: 2NO+O2Û2NO2, но вероятность встречи одновременно 3х молекул крайне низка.
Реакция более высокой молекулярности, чем 3х не известны.
В тех случаях, когда из уравнения реакции следует, что молекулярность более 3х, на самом деле реакция протекает более сложным путем - проходит через ряд промежуточных стадий, молекулярность которых, как правило, 1 или 2.
Каждому типу реакций соответствует кинетическое уравнение, которое выражает зависимость скорости химической реакции от концентрации реагирующих веществ. По форме зависимости скорости от концентрации V = f(с) реакции делятся на первого второго и третьего порядка. В реакциях второго, третьего порядка v зависит от с во второй и третьей степени.
В общем случае порядок реакции определяется как сумма стехиометрических коэффициентов взаимодействующих реагентов.
aA+bBÛcC+dD порядок данной реакции n=a+b, т.е. на первый взгляд порядок реакции совпадает с ее молекулярностью. Но это совпадение наблюдается лишь в самых простых случаях. Многие, например бимолекулярные реакции, описывают кинетическим уравнением первого порядка. Такое понижение порядка, как правило, следствие того, что один из реагентов находится в большом избытке, и в процессе реакции его (С) изменяется незначительно, т.е. u реакции зависит только от изменения (С) другого компонента.
Пример: C12H22O11+H2OизбÛ2С6H12O6 – гидролиз тростникового сахара.
Причина несовпадения молекулярности и порядка реакций объясняется тем, что стехиометрические уравнения описывают процесс в целом и не отражают истинного механизма реакций, протекающих через ряд последовательных стадий.