рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Де Dх і Dр – невизначеності у величинах відповідно координати й імпульсу.
Реферат Курсовая Конспект
Де Dх і Dр – невизначеності у величинах відповідно координати й імпульсу.
Де Dх і Dр – невизначеності у величинах відповідно координати й імпульсу. - раздел Химия, МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ Приклад 1. Оцініть Швидкість Електрона В Атомі. Розв’Язанн...
Приклад 1. Оцініть швидкість електрона в атомі.
Розв’язання. Приймемо в співвідношенні невизначеностей Dх рівною порядку розміру атома: Dх »1 Å= =10-10 м. Знаходимо невизначеність імпульсу для такого стану електрона:
Dр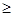 h /2p × Dх = 6,63×10-34 /2 ×3,14 × 10-10 = 1,06 × 10-24 Дж×с/м.
h /2p × Dх = 6,63×10-34 /2 ×3,14 × 10-10 = 1,06 × 10-24 Дж×с/м.
Далі, враховуючи значення маси електрона (кг), знаходимо невизначеність його швидкості:
Dv = Dр / mē = 1,06× 10-24/ 9,1× 10-31 = 1,16× 106 м/с.
Швидкість не може бути меншою своєї невизначеності. Отже вона більша за 1,16×106 м/с, і це значення можна оціночно прийняти за швидкість електрона в атомі. Зверніть увагу, що вона більш ніж на два порядки менша максимальної швидкості у природі – швидкості світла (с = 3×108м/с). Поясніть, чому при розгляді електронної структури атомів зневажають хвильовими властивостями ядра. Довжина хвилі якої мікрочастинки визначає розмір атома? Що таке атомна орбіталь електрона і як це поняття співвідноситься з класичним поняттям орбіти?
Стан мікрочастинки, а також системи частинок, цілком визначається хвильовою функцією Ψ (читається: "псі"). У звичайному, так званому координатному, представленні Ψ – функція, що залежить від координат і часу : Ψ = Ψ(x, y, z, t). У загальному випадку Ψ – комплексна функція, зокрема, вона може приймати позитивні і негативні дійсні значення. Фізичний зміст має квадрат модуля хвильової функції |Ψ|2 – це густина ймовірності виявлення частинки у точці з координатами x, y, z. Це означає, що ймовірність знайти частинку у деякому малому об’ємі dV дорівнює |Ψ|2×dV Хвильову функцію знаходять із розв’язання рівняння Шредингера – основного рівняння квантової механіки.
Так, для частинки масою m , що рухається у потенційному полі (наприклад, електрон у полі електричного притягання ядра атома водню), рівняння Шредингера має вигляд

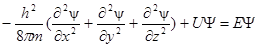 ,
,
де U – потенційна , а E – повна енергія частинки.
Як диференційне рівняння в частинних похідних, рівняння Шредингера при E < 0 (тобто якщо електрон не відірваний від атома ) має не безперервний, а дискретний набір рішень: Ψ1, Ψ2, Ψ3 , … . Цьому відповідає дискретний ряд (квантованість) можливих значень енергії електрона, моменту його орбітального імпульсу (кількості руху), проекції цього моменту на деякий виділений напрямок.
Квантованість станів электрона в атомі відображають квантові числа, які можна розглядати як набір номерів рішень рівняння Шредингера. Особливу увагу варто приділити фізичному змісту і можливим значенням квантових чисел (див. табл.1). Зверніть увагу на прийняті буквені позначення підрівнів.
Таблиця 1
Основні властивості квантових чисел електрона в атомі
| Квантове число | Можливе значення | Число можливих значень | Физичний зміст (що визначає квантове число) |
| Головне n | 1, 2, 3, 4… K,L,M,N... | ∞ | Енергію електрона на даному рівні. Середню відстань електрона від атомного ядра (розмір електронної хмари). Порядковий номер енерге-тичного рівня (електронної оболонки, шару). |
| Орбіталь-не (побі-чне) l | 0,1,2,...(n-1) s,р,d, f... | N | Орбітальний момент імпуль-су і магнітний момент електрона. Енергію електро-на на підрівні даного рівня багатоелектронного атома. Форму орбіталі. Енергетич-ний підрівень. |
| Магнітне ml | -l … 0 … +l | ( 2l+1 ) | Проекцію орбітального моменту на виділений напрямок. Просторову орієн-тацію орбіталі (електронної хмари). |
| Спінове ms | +½ і -½
| Власний момент імпульсу і магнітний момент електрона (один із двох можливих способів “обертання” електрона). |
Проаналізувавши вміст таблиці, спробуйте відповісти на такі питання: які квантові числа та чи у однаковій мірі визначають енергію електрона в атомі? Які енергетичні рівні не мають: а) p-, б) d-, в) f- підрівнів? Чи можлива відсутність на рівнях s-підрівня? Скільки різних орієнтацій можуть мати орбіталі d-підрівня?
Кожен дозволений стан електрона в атомі характеризується конкретним набором усіх чотирьох квантових чисел. Припустимий набір перших двох квантових чисел (n і l) визначає конкретний підрівень, тобто підрівень розглянутого енергетичного рівня. При цьому використовуються буквені позначення для орбітального квантового числа (табл.1): 2s (n=2, l=0), 2p (n=2, l=1), 3d (n=3, l=2).
Допустимий набір перших трьох квантових чисел однозначно визначає атомну орбіталь (АО) електрона:
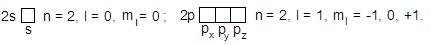
Вказуючи атомну орбіталь, до позначення підрівня додають підрядковий індекс, що показує її орієнтацію щодо осей координат і відповідає визначеному значенню ml. Якщо орієнтація спеціально не вказується, індекс опускають, наприклад, 3d- або d-орбіталі. На графічних схемах АО позначають умовно "квантовими комірками" 1, а електрони – стрілками, що дає можливість розрізняти орієнтацію їх спінів:
 ( ms = +½ ) та
( ms = +½ ) та  ( ms = -½ ).
( ms = -½ ).
Приклад 2. Складіть графічну схему орбіталей 4-го енергетичного рівня.
Розв’язання. При n = 4 можливі наступні значення l = 0, 1, 2, 3. Відповідно цьому, 4-й рівень включає s-, p-, d- і f – підрівні (табл.1). Комірки, що зображують орбіталі одного підрівня, розташовуємо поруч по горизонталі, тому що енергія електронів на них однакова. Число орбіталей-комірок на підрівні дорівнює числу можливих значень ml, тобто (2l +1) або одна на s-, три на p-, п'ять на d- і сім на f-підрівнях. Значення ml записуємо під кожною з комірок. Розв’язок виглядає в такий спосіб:
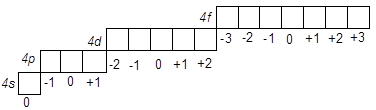
Порядок заповнення орбіталей у багатоелектронних атомах визначається двома основними принципами: принципом найменшої енергії і принципом Паулі. По першому з них, електрони в незбуджених атомах займають ті АО, на яких їх енергія найменша.
За принципом Паулі (в атомі не може бути двох електронів з однаковим набором усіх чотирьох квантових чисел) на одній орбіталі не може бути більше двох електронів. Допускаються лише такі чотири варіанти заповнення кожної окремої АО:



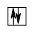
(вільна АО) (пара з протилежними спінами)
Звідси можна послідовно визначити електронну ємність (максимально можливе число електронів) рівнів і підрівнів (табл.2).
Таблиця 2.
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ
МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ... ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Де Dх і Dр – невизначеності у величинах відповідно координати й імпульсу.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов