рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Електронні сімейства елементів
Реферат Курсовая Конспект
Електронні сімейства елементів
Електронні сімейства елементів - раздел Химия, МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ Електронне Сімейство Положення ...
| Електронне сімейство | Положення в періодичній таблиці | Коротка електронна формула |
| s- сімейство р- сімейство d- сімейство f – сімейство | головні підгрупи I - II груп і елемент He головні підгрупи III - VIII груп (виключаючи He) побічні підгрупи I-VIII груп лантаноїди та актиноїди | ns1-2 ns2np1-6 ns2(n – 1)d1-10 ns2(n – 1)d1(n-2)f1-14 |
Щоб скласти скорочену електронну формулу елемента, виходячи з узагальненої формули сімейства, необхідно:
- визначити, до якого сімейства відноситься елемент і взяти відповідну узагальнену формулу;
- підставити в цю формулу значення n, що дорівнює номеру періоду, у якому розташований елемент;
- визначити кількість електронів на заповнюваному підрівні, відрахувавши від першого елемента сімейства у даному періоді і підставити цю кількість у формулу.
Для наочності розподіл електронів на підрівнях показують за допомогою графічних схем валентних орбіталей. Вони використовуються наряду з короткими електронними формулами.
Приклад 4. Напишіть короткі електронні формули і побудуйте графічні схеми валентних орбіталей зазначених атомів: Са, Ni, Se, Sm.
Розв’язання. Са – другий від початку IV періоду елемент s-сімейства:
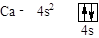
Ni – восьмий, відраховуючи від Sc, d-элемент IV періоду:
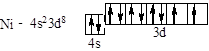
Se – четвертий, відраховуючи від Ga, p-элемент IV періоду:
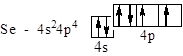
Sm – п¢ятий від Ce у ряду лантаноїдів – f-элементів VI періоду:
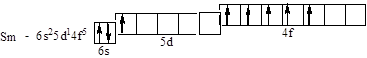
На електронну структуру деяких атомів впливає симетрія електронного розподілу. Наприклад, електронну формулу атома хрому – четвертого, відраховуючи від скандію Sc, у сімействі d-елементів IV періоду – за викладеними правилами варто записати так: 4s23d4. Однак, реалізується конфігурація з заповненими по одному електрону п'ятьма d- орбіталями, що має більш симетричний розподіл електронного заряду (і тому – меншу енергію): 4s13d5. З цієї ж причини електронна конфігурація міді в основному стані не 4s23d9, а 4s13d10. Така ситуація одержала назву "провал електрона" (з n на (n-1) рівень). Найбільшій симетрії відповідають цілком або наполовину заповнені підрівні (p3 і p6, d5 і d10, f7 і f14). У атома паладія Pd з 5s-підрівня "провалюються" обидва електрони: 4s24p65s24d8 ® 4s24p64d10. Тому паладій – єдиний елемент періодичної системи, у якого головне квантове число електронів зовнішньої оболонки не збігається з номером періоду.
Будьте уважні при роботі з елементами d- і f- сімейств. Якщо вам потрібна точна електронна формула, звіряйтеся зі спеціальними таблицями електронних конфігурацій.
Варто пам'ятати, що всі розглянуті електронні формули відносяться до атомів, що знаходяться в стаціонарному (незбудженому) стані. Однак за певних умов може відбуватися розпаровування електронних пар при переході атомів у збуджений стан, внаслідок чого кількість неспарених електронів зростає. При цьому електрони переходять (промотуються) на вільну орбіталь розташованого вище по енергії підрівня в межах того ж енергетичного рівня.
Приклад 5. Складіть короткі електронні формули і графічні схеми атома хлору в основному (стаціонарному) і збудженому станах.
Розв’язання. Складаємо електронну формулу і схему електронної структури атома хлору в основному стані:
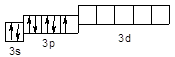
Cl – 3s23p5
У збудженому стані (позначається символом * ) спарені 3s і 3p електрони можуть роз'єднуватися, переходячи на вільні орбіталі підрівня 3d:
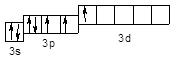
Cl* – 3s23p43d1
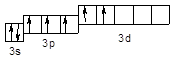
Cl** – 3s23p33d2
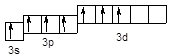
Cl*** – 3s13p33d3
Зверніть увагу, що атом хлору може існувати у трьох збуджених станах. Чи можлива наявність збудженого стану у атома фтору? Поясність вашу відповідь.
Навчившись писати короткі електронні формули атомів елементів, неважко складати електронні формули іонів, що відповідають існуванню елементів у різних ступенях окиснення. Для цього спочатку складають короткі електронні формули нейтральних атомів, а потім добавляють до неї (при утворенні аніонів) або видаляють (при утворенні катіонів) відповідну кількість електронів.
Приклад 6. Складіть електронні формули іонів і елементів у різних ступенях окиснення: S2- , S+2 , S+4 , S+6.
Розв’язання. Спочатку складаємо коротку електронну формулу і графічну схему атома S:
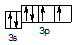
S0 3s23p4
Для одержання іона S2- до S0 необхідно додати два електрона:
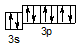
S2- 3s23p6
Щоб перейти від S0 до станів S+2, S+4, S+6 необхідно видалити з нейтрального атома сірки два, чотири або шість електронів відповідно.
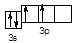
S+2 3s23p2
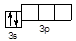
S+4 3s2 3p0
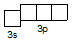
S+6 2s22p63s03p0
ДОМАШНЄ ЗАВДАННЯ
1. Який елемент має в атомі п'ять електронів, для кожного з яких n =3 і l =2? Чому дорівнюють для них значення ml? Чи повинні вони мати антипаралельні спіни?
2. Який елемент має чотири електрони, для кожного з яких
n = 4 і l = 1? Чому дорівнюють для них значення ml? Скільки електронів мають антипаралельні спіни?
3. Укажіть значення квантових чисел n, l і ml для валентних електронів в атомах елементів з порядковими номерами 19, 23, 27, 30, 33 і 36. Для визначення значень ml виходьте з припущення, що орбіталі кожного підрівня заповнюються в порядку збільшення ml, починаючи з його найбільш негативного значення.
4. Скільки електронних шарів і яке число електронів містить атом з валентною оболонкою: а) 4s24p5; б) 4s23d5; в) 5s25p3 ?
5. В атомі деякого елемента є п'ять електронних шарів і 6 валентних електронів. Якими квантовими числами вони характеризуються?
6. Які з приведених електронних конфігурацій неможливі і чому: 3s23p5, 3s22d6, 4s24p7, 2s32p3, 5s24d8, 4s23d12, 3s23p2, 5s23f15, 6s24f5, 2s12p3, 4s13d10, 4s23d54p1?
7. Яку з вільних атомних орбіталей (АО) заповнить черговий електрон відповідно до правил Клечковського: а) 4d- чи 5s-; б) 5p- чи 4d-; в) 5f- чи 4d-; г) 5p- чи 6s-; д) 5f- чи 6s- ?
8. Для скількох АО сума (n + l) = 8? Чи заповнені такі орбіталі в незбуджених атомах елементів періодичної системи? Атоми яких елементів мають найбільше значення суми (n + l)?
9. Скільки електронних шарів мають атоми елементів з порядковими номерами 8, 10, 18, 35, 39, 56, 80, 86? Скільки з них заповнені цілком і скільки частково? Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
10. Визначте сумарний спін валентних електронів в атомах елементів з порядковими номерами 19, 20, 22, 25, 27, 30, 33, 36. Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
У задачах 11-20 напишіть скорочені електронні формули і побудуйте графічні схеми валентних орбіталей зазначених елементів у різних ступенях окиснення.
11. Ca, Cr, Se, Se-2, Se+6
12. Ge, Zr, Rb, Rb+, Br-
13. Sr, Nb, Sb, Al+3, F-
14. Cs, Ta, B, B+3 , Br+5
15. C, Ti, He, Ti+3, Ti+4
16. W, Sb, Ra, Cl-, Cl+5
17. Na, Zn, As, Mn+2, Mn+4
18. Au, Mg, Pb, Pb+2, Pb+4
19. K, Cu, P, Cu+, Cu+2
20. Br, V, Be, Be+2, H-
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ
МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ... ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Електронні сімейства елементів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов