рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- НАЙПРОСТІШІ СТЕХІОМЕТРИЧНІ РОЗРАХУНКИ
Реферат Курсовая Конспект
НАЙПРОСТІШІ СТЕХІОМЕТРИЧНІ РОЗРАХУНКИ
НАЙПРОСТІШІ СТЕХІОМЕТРИЧНІ РОЗРАХУНКИ - раздел Химия, МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ Мета Вивчення Теми: Робити Розрахунки По Хімічних Формулах І Рівнянн...
Мета вивчення теми:
робити розрахунки по хімічних формулах і рівняннях, що пов'язані з визначенням:
- процентного складу речовини;
- кількості продуктів реакції по заданих кількостях вихідних речовин;
- кількості вихідних речовин по заданих кількостях продуктів реакції;
- кількості речовини, що залишилася в надлишку.
Відношення мольних кількостей, мас і об¢ємів речовин, що відповідають рівнянню даної реакції, називають стехіометричними співвідношеннями, а кількісні розрахунки за формулами та рівняннями - стехіометричними розрахунками.
В основі всіх кількісних розрахунків лежить закон збереження маси, встановлений М.В.Ломоносовим: маса речовин, що вступають у реакцію, дорівнює масі продуктів реакції. Тому можна знайти невідому масу однієї з взаємодіючих речовин.
Приклад 1. Карбонат кальцію розкладається при нагріванні на СаО і CO2. Яка маса природного вапняку, що містить 90 % (мас.) СаСО3 буде потрібна для одержання 7 т негашеного вапна СаО ?
Розв’язання. Запишемо рівняння реакції розкладу карбонату кальцію:
СаСО 3 ® СаО + CO 2.
Визначимо кількість речовини СаO, що міститься в 7 т негашеного вапна:
n(СаO) = m(СаO)/М(СаO), де m (СаO) - маса оксиду кальцію (негашеного вапна), г;
М(СаO) - молярна маса негашеного вапна, г/моль;
М(СаO)= 40+16= 56 г/моль.
 n(СаО) = 7× 106 ¤ 56= 1,25 ×105 моль.
n(СаО) = 7× 106 ¤ 56= 1,25 ×105 моль.
Визначимо кількість речовини карбонату кальцію, необхідну для одержання 1,25·105 моль СаО. З рівняння реакції випливає, що з одного моля СаСО3 утворюється один моль СаО, тобто
n(СаСО3) = n(СаО) = 1,25 × 105 моль.
Визначимо масу 1,25×105 моль СаСО3:
m(СаСО 3) = n(СаСО 3)× М(СаСО 3).
Враховуючи, що М(СаСО 3) = 40 + 12 + 3∙16 = 100 г/моль, маємо:
m(СаСО3) = 1,25×105×100 = 1,25× 10 7 г = 12,5 т.
Така кількість карбонату кальцію буде потрібна для одержання 7 т СаО. Однак, вапняк складається із СаСО3 на 90 %. Обчислимо масу вапняку, що містить 12,5 т СаСО 3:
m(СаСО3) = m(вапняку)×w(СаСО3),
де w(СаСО3) – масова частка СаСО3 у вапняку в частках одиниці.
У такий спосіб: m(вапняку) = m(СаСО 3)/w(СаСО 3), m(вапняку) = 12,5/0,9 = 13,9 т.
Оскільки при однаковій температурі й однаковому тиску мольні об'єми будь-яких газів і парів рівні між собою, коефіцієнти в рівняннях реакцій між газоподібними речовинами вказують не тільки на співвідношення між числом реагуючих молекул (молей) і молекул (молей), що утворюються, але і на об'ємні співвідношення вихідних і кінцевих газоподібних продуктів реакції. Об'єми газів, що беруть участь у реакції, пропорційні стехіометричним коефіцієнтам у рівнянні реакції.
Приклад 2. Який об'єм кисню необхідний для каталітичного окиснення 200 л аміаку (н.у.), що протікає за рівнянням
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
і який сумарний об'єм продуктів реакції?
Розв’язання. З рівняння реакції видно, що на окиснення чотирьох мольних об'ємів аміаку потрібно п'ять мольних об'ємів кисню. В зв'язку з тим, що гази знаходяться при однакових умовах, їхні мольні об'єми рівні між собою. Тоді V(NH3) : V(O2) = 4:5. Отже: V(O2) = (5/4) ∙ V(NH3). Знаходимо об'єм кисню:
V(O2) = (5¤ 4) × 200 = 250 л.
З рівняння реакції також видно, що з чотирьох об'ємів NH3 утворюються чотири об'єми NO і шість об'ємів водяної пари, разом 10 об'ємів газоподібних продуктів.
V(NH3) : V продуктів = 4:10
Звідси легко обчислити сумарний об'єм газоподібних продуктів, що утворюються з 200 л NH3 :
V продуктів = (10 ¤ 4) ∙ V(NH3) = (10 ¤ 4) ∙ 200 = 500 л.
При проведенні розрахунків по рівняннях гетерогенних реакцій доцільно виражати кількості твердих речовин в одиницях маси, а кількості газоподібних – відразу в одиницях об'єму. Тоді по рівнянню реакції встановлюють співвідношення мас і об'ємів.
Приклад 3. Який об'єм при 1270С и тиску 121,56 кПа диоксиду сірки отримано при випалі 1 т залізного колчедану, що містить 90 % FeS2?
Розв’язання. Складемо рівняння реакції випалу FeS2:
4FeS2 +11O2 = 2Fe2O3 + 8 SO2
Знайдемо масу FeS2, що міститься в 1 т залізного колчедану: m(FeS2) = m(колчедану)×w(FeS2) . Враховуючи, що m(колчедану)=1 т, а w(FeS2)= 0,9, маємо: m(FeS2)=1×0,9 =0,9 т.
Визначимо кількість речовини, що міститься в 0,9 т FeS2:
n(FeS2) = m(FeS2)/M(FeS2), де M(FeS2) – молярна маса FeS2, що дорівнює 119,9 г/моль.
n(FeS2) = 0,9×106/119,9 = 7,51×103 моль.
З рівняння реакції випливає, що з 4 моль FeS2 утворюється 8 моль SO2 , тобто
n(SO2) : n(FeS2) = 8 : 4 = 2:1 і
n(SO2) = 2n(FeS2) = 2 ×7,51×103 = 1,5×104 моль.
Знаходимо об'єм SO2, що утворюється за нормальних умов (Vо):
Vо(SO2) = n(SO2) ×Vm = 1,5×104 × 22,4 = 3,36×105 л = 336 м3 .
Приведемо об'єм диоксиду сірки до заданих умов, скориставшись рівнянням об'єднаного газового закону:
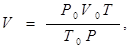
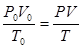 і
і
де усі величини з нижніми індексами “0” відповідають нормальним умовам.
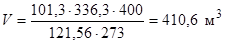
Якщо в умові задачі задані кількості двох або більшого числа вихідних речовин, то всі розрахунки проводять по тому з учасників реакції, що знаходиться в недостачі, тому що саме цей реагент цілком вступає в реакцію.
Приклад 4. Змішали 7,30 г HCl з 4,00 г NH3. Скільки грамів NH4Cl може утворитися? Знайти масу газу, що залишається після реакції.
Розв’язання. Складемо рівняння реакції утворення NH4Cl:
NH3 + HCl = NH4Cl
Перевіримо, чи в стехіометричному співвідношенні взяті вихідні речовини. Для цього знайдемо кількість речовини n кожного з реагентів:
n(HCl) = m(HCl) / M(HCl) = 7,30 / 36,5 = 0,200 моль;
n(NH3) = m(NH3) / M(NH3) = 4 / 17 = 0,235 моль.
З рівняння реакції випливає, що 1 моль HCl взаємодіє з
1 моль NH3, а кількості молей, задані в умові задачі, відносяться як 0,2 : 0,235. Отже, HCl може цілком вступити в реакцію, а NH3 залишиться в надлишку. Значить, всі розрахунки повинні проводитися по HCl. Знайдемо кількість речовини NH4Cl, що утворюється. По рівнянню реакції: n(NH4Cl) = n(HCl) = 0,2 моль.Тоді маса продукту m(NH4Cl) =
= n(NH4Cl)×M(NH4Cl) = 0,2×53,5 = 10,7 г. Обчислимо кількість речовини аміаку, що залишилась після реакції Dn(NH3):
Dn(NH3) = n(NH3) - n'(NH3),
де n'(NH3)–кількість речовини аміаку, що вступила у реакцію, n'(NH3) = n(HCl) = 0,2 моль, Dn(NH3) = 0,235-0,2 = 0,035 моль.
Знаходимо масу надлишкової кількості аміаку Dm(NH3):
Dm(NH3) = Dn(NH3) × M(NH3) = 0,035×17 = 0,6 г.
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ
МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ... ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: НАЙПРОСТІШІ СТЕХІОМЕТРИЧНІ РОЗРАХУНКИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов