рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ЕКВІВАЛЕНТИ ПРОСТИХ ТА СКЛАДНИХ РЕЧОВИН
Реферат Курсовая Конспект
ЕКВІВАЛЕНТИ ПРОСТИХ ТА СКЛАДНИХ РЕЧОВИН
ЕКВІВАЛЕНТИ ПРОСТИХ ТА СКЛАДНИХ РЕЧОВИН - раздел Химия, МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ Мета Вивчення Теми : - Розраховувати Еквіваленти Та Молярні Маси Екв...
Мета вивчення теми :
- розраховувати еквіваленти та молярні маси еквівалентів простих речовин, оксидів, кислот, основ і солей;
- використовувати закон еквівалентів в розрахунках за хімічними формулами та рівняннями.
Еквівалент визначають як реальну або умовну частинку, яка реагує (тобто приєднує, визволяє або обмінює) з одним іоном водню. Під умовною розуміємо якусь частку реальної частинки.
Еквівалент в окисно-відновних реакціях (ОВР) – це реальна або умовна частинка, яка приєднує або віддає один електрон.
Число, яке показує, яка частка молекули реагує (еквівалентна) з одним іоном водню в даній кислотно-основній реакції або з одним електроном в даній окисно-відновній реакції, називається фактором еквівалентності f, який розраховується за формулою:
f = 1/z (1)
В обмінних реакціях z дорівнює абсолютній величині сумарного заряду іонів, які інший реагент обмінює з даною речовиною .
В окисно-відновних реакціях z дорівнює кількості електронів, які приймає (віддає) одна частинка окисника (відновника).
Еквівалент речовини В записують так:
Е(В) = f× В,
де В – хімічна формула речовини, а еквівалент катіона В+ або аніона В- виражають як:
Е(В) = f В+,
Е(В) = f В-,
де В+ чи В- - формули іонів.
Приклад 1. Розрахувати фактори еквівалентності і еквіваленти оксиду алюмінію в реакціях: а) з сірчаною кислотою з утворенням середньої солі; б) з гідроксидом натрію з утворенням метаалюмінату.
Розв’язання. а) Реакція обміну здійснюється за рівнянням:
Al2O3 + 3H2SO4 ® Al2(SO4)3 + 3H2O
З рівняння видно, що одна "молекула" Al2O3 реагує з шістьма іонами водню з утворенням води. Робимо висновок, що одному іону водню еквівалентна шоста частина молекули Al2O3, це означає, що f(Al2O3)=1/6. До такого ж висновку можна прийти в результаті іншого міркування. Три сульфат-іони SO42- (які еквівалентні шістьом іонам водню) обмінюють у "молекулі" Al2O3 три іони кисню. Сумарний заряд трьох сульфат-іонів дорівнює шести (як і сумарний заряд трьох іонів О2-). Тоді згідно з формулою (1), f(Al2O3)=1/6, тоді Е(Al2O3)=1/6 Al2O3.
б) Al2O3 + 2NaOH ® 2NaAlO2 + H2O
Це обмінна реакція. Одна "молекула" Al2O3 реагує з двома гідроксид-іонами, еквівалентними двом іонам водню. Тому одному іону водню еквівалентна половина молекули Al2O3 і тоді: f (Al2O3)=1/2, а Е(Al2O3)=1/2 Al2O3.
Якщо реакція, в якій приймає участь оксид, невідома, то за його формулою звичайно визначають найменше значення фактора еквівалентності:
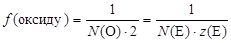
де N(О) і N(Е) – відповідно кількість атомів кисню і елемента в формулі оксиду, а 2 і z(E) – заряди іонів кисню і елемента. Наприклад, для Al2O3 за його формулою:
f = 1/6, а Е(Al2O3) = 1/6 Al2O3
Приклад 2. Обчислити еквівалент і фактор еквівалентності фосфорної кислоти в реакції:
Н3PO4 + 2NaOH ® Na 2HPO4 + 2H2O
Розв’язання. З рівняння реакції видно, що в кожній молекулі Н3PO4 два іони водню обмінюються на два іони натрію. Сумарний заряд іонів водню, що обмінюються, дорівнює двом (так само, як і сумарний заряд іонів натрію). Згідно з формулою (1): f(Н3PO4)=1/2, Е(Н3PO4)=1/2 Н3PO4.
Кількість атомів водню в молекулі кислоти, що обмінюються на основні залишки, називається основністю кислоти. Для розрахунку фактора еквівалентності кислоти використовується формула:
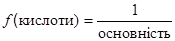
В реакції, що розглядається, основність фосфорної кислоти дорівнює двом (два атоми водню обмінюються на два основних залишки Na+) і f(Н3PO4)=1/2,а Е(Н3PO4)= =1/2 Н3PO4.
Одноосновні кислоти мають одне значення еквівалента, що у всіх реакціях за їх участю співпадає з їх молекулами.
Приклад 3. Розрахувати фактор еквівалентності і еквівалент гідроксиду кальцію в реакції:
Ca(OH)2 + HCI ® CaOHCl + H2O
Розв’язання. В кожній молекулі Са(ОН)2 тільки один гідроксид-іон, заряд якого дорівнює одиниці, обмінюється в цій реакції на хлорид-іон. За формулою (1): f(Са(ОН)2) = 1.
Кількість гідроксид-іонів в молекулі основи, що обмінюються на кислотні залишки, називається кислотністю основи:
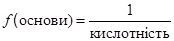
У тій реакції, що розглядається, в молекулі Са(ОН)2 тільки один гідроксид-іон обмінюється на хлорид-іон, тому кислотність Са(ОН)2 дорівнює одиниці:
f(Са(ОН)2) = 1; Е(Са(ОН)2) = Са(ОН)2.
Однокислотні основи теж мають одне значення еквівалента в усіх реакціях за їх участю. Так, еквівалент гідроксиду натрію завжди дорівнює його молекулі.
Приклад 4. Розрахувати фактор еквівалентності і еквівалент Na2CO3.
Розв’язання. Оскільки не задана реакція за участю цієї солі двохосновної кислоти, то визначити конкретний вираз еквівалента неможливо. У цьому випадку звичайно вказують найменше значення фактора еквівалентності:
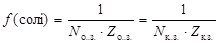
 (2)
(2)
де Nо.з. і Nк.з. – кількості основних і кислотних залишків, Zо.з. і Zк.з. – заряди основних і кислотних залишків.
Згідно з формулою, що наведена вище:
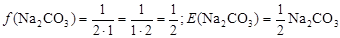
Приклад 5. Розрахувати фактори еквівалентності і еквіваленти Na2CO3 в реакціях з соляною кислотою з утворенням кислої солі та вуглекислоти.
Розв’язання. а) Кисла сіль утворюється при еквімолярному (1:1) співвідношенні реагентів:
Na2CO3 + HCI ® NaHCO3 + NaCI
До кислотного залишку солі Na2CO3 приєднується один іон водню. Фактор еквівалентності дорівнює одиниці і еквівалентом Na2CO3 у цій реакції є молекула: Е(Na2CO3) = =Na2CO3.
б) Вугільна кислота утворюється при співвідношенні реагентів 1: 2 :
Na2CO3 + 2НCI ® H2CO3 + 2NaCI
До кислотного залишку солі приєднуються два іони водню. Одному іону водню еквівалентна половина молекули Na2CO3 і Е(Na2CO3)=1/2Na2CO3. Той же самий результат можна отримати за формулою (2). Сумарний заряд двох іонів натрію, що обмінюються, як і сумарний заряд двох іонів водню, дорівнює двом.
Приклад 6. Визначити фактори еквівалентності і еквіваленти алюмінію і кисню в реакції:
0 0 +3 -2
4AI + 3O2 ® 2AI2O3
Розв’язання. Це окисно-відновна реакція. Окисником в цій реакції є кисень. Одна молекула О2 приймає чотири електрони, тому що ступінь окиснення елемента кисню змінюється від 0 до –2. Тоді за формулою (1):
f(О2)=1/4; Е(О2) = 1/4 О2.
Отже еквівалентом кисню є умовна частинка, яка дорівнює четвертій частині його молекули. Відновником в цій реакції є алюміній. Один атом алюмінію віддає три електрони, коли ступінь окиснення змінюється від 0 до +3, тому f(Al)=1/3; E(Al)=1/3Al. Еквівалентом алюмінію є умовна частинка, яка дорівнює третій частині його молекули.
Молярна маса еквівалентів речовини Мекв – маса 1 моля еквівалентів цієї речовини. Вона дорівнює добутку фактора еквівалентності на молярну масу речовини:
Мекв = f×М,
де М – молярна маса речовини, г/моль.
Молярну масу еквівалентів можна позначати також за загальним правилом літерою М, якщо в дужках вказувати ту частинку, що є еквівалентом даної речовини. Наприклад, молярна маса еквівалентів водню позначається як М(1/2Н2), молярна маса еквівалентів кисню – М(1/4О2). Корисно пам'ятати молярні маси еквівалентів водню і кисню
М(1/2Н2) = 1г/моль, М(1/4О2) = 8г/моль.
Для газоподібних речовин застосовують поняття молярного об¢єму еквівалентів Vекв - об¢єму 1 моля еквівалентів газу. Значення цієї величини розраховується за формулою:
Vекв = f×Vm,
де Vm – молярний об¢єм газу, що за нормальних умов (0°С і 101,3 кПа) дорівнює 22,4 л/моль. Зверніть увагу, що
V(1/2Н2) = 11,2 л/моль, а V(1/4 О2) = 5,6 л/моль.
Еквівалент і молярна маса еквівалентів – часто величини змінні. Їх значення залежать від хімічної природи сполук і від реакцій за їх участю. З цієї причини про молярну масу еквівалентів елемента можна говорити, розглядаючи лише конкретну сполуку, а про молярну масу еквівалентів сполуки – конкретну реакцію, у якій вона приймає участь.
Кількість речовини еквівалентів nекв можна обчислити за загальними правилами, виходячи із маси речовини, або об¢єму газу за нормальних умов:
nекв= m/Mекв або nекв= V/Vекв
Приклад 7. Розрахуйте кількість речовини еквівалентів: а) в 10 г Н2; б) в 44,8 л (н.у.) Н2.
Розв’язання. Використовуючи наведені вище формули обчислимо:
а) 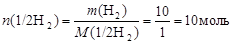 і
і
б) 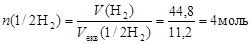
В хімічних розрахунках часто використовують закон еквівалентів:
Кількість молей еквівалентів всіх речовин, які беруть участь у реакції, однакова.
Для реакції аА + вВ ® сС + дД математичний вираз закону еквівалентів має вигляд:
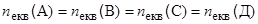
Підставляючи замість nекв вираз для кількості речовини через масу або об¢єм, отримуємо ще два вирази для закону еквівалентів:

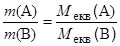 і
і 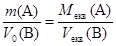
Перше із цих рівнянь дозволяє дати таке формулювання: маси речовин, що приймають участь у реакції, співвідносяться як молярні маси їх еквівалентів.
Приклад 8. Визначте фактори еквівалентності і еквіваленти усіх речовин, що беруть участь в реакції
Na2O + H2O ® 2NaOH
Розв’язання. При розв’язанні такої задачі зручно записувати усі викладки рядками під рівнянням реакції.
Розв’язок має вигляд:
Na2O + H2O ® 2NaOH
n(молекул) 1 1 2
n(еквівалентів) 2 2 2
f ½ ½ 1
E 1/2Na2O 1/2H2O NaOH
У першому рядку проставляємо кількості молекул, що приймають участь у реакції. Ці кількості дорівнюють коефіцієнтам в рівнянні реакції.
У другому рядку записуємо числа еквівалентів речовин. Однокислотна основа NaOH має постійний еквівалент у всіх реакціях. Її фактор еквівалентності f =1 і еквівалент Е = NaOH записуємо у третьому і четвертому рядках. Оскільки в цій реакції беруть участь дві молекули NaOH, а еквівалентом є одна молекула, то в реакції приймають участь два еквіваленти NaOH. Цю цифру записуємо у другому рядку.
Інші речовини, наприклад вода, в різних реакціях мають неоднаковий еквівалент. Але в даній реакції, за законом еквівалентів, числа еквівалентів усіх речовин однакові і дорівнюють двом.
Для знаходження факторів еквівалентності і еквівалентів Na2O і Н2О звернемо увагу, що в реакції приймають участь по одній молекулі і по два еквіваленти кожної з цих речовин, отже еквівалентом їх є половина молекули, а f = 1/2.
Приклад 9. Метал масою 98,1 г при взаємодії з кислотою витискує 33,6 л водню, виміряного за нормальних умов. Визначте молярну масу еквівалентів металу.
Розв’язання. Згідно з законом еквівалентів:
nекв(Me) = n(1/2 H2)
або після підставлення виразів числа молей через масу і об’єм
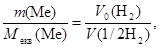
звідки:
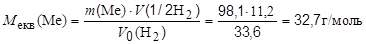
Молярна маса еквівалентів складної речовини дорівнює сумі молярних мас еквівалентів її складових частин.
Для оксидів:
Мекв(оксиду) = Мекв(елемента) + М(1/4 О2)
або
Мекв(оксиду) = Мекв(елемента) + 8
Для кислот:
Мекв(кислоти) = М(1/2 Н2) + Мекв(кислотного залишку)
або
Мекв(кислоти) = 1 + Мекв(кислотного залишку),
Для основ:
Мекв(основи) = Мекв(основного залишку) + Мекв(ОН-)
враховуючи, що Мекв(ОН-) = 17 г/моль
Мекв(основи) = Мекв(основного залишку) + 17
Для солей
Мекв(солі)= Мекв(осн.залишку)+Мекв(кисл.залишку)
Приклад 10. Розрахувати можливі значення молярної маси еквівалентів гідроксиду алюмінію.
Розв’язання. Згідно з формулою
Мекв(основи) = Мекв(осн.залишку) + 17
гідроксид алюмінію в різних реакціях утворює такі основні залишки: а) Al(OH)2+, б) AlOH2+ i в) Al3+. Їм відповідають такі значення молярних мас еквівалентів:
а) Мекв(Al(OH)3) = Мекв(Al(OH)2+) +17 = (27 + 2×17)/1 +17 = = 78 г/моль;
б) Мекв(Al(OH)3) = Мекв(AlOH2+) + 17 = (27 + 17)/2 +17 = = 39 г/моль;
в) Мекв(Al(OH)3) = Мекв(Al3+) + 17 = 27/3 + 17 = 26 г/моль.
ДОМАШНЄ ЗАВДАННЯ
1. Розрахуйте молярні маси еквівалентів оксиду свинцю (IV) в реакціях: PbO2 + 2H2SO4 ® Pb(SO4)2 + 2H2O
PbO2 + 2NaOH ® Na 2PbO3 + H2O
Відповідь: 59,75 г/моль; 119,5 г/моль.
2. Розрахуйте можливі значення молярних мас еквівалентів наступних речовин за їх формулами: H2SeO4, Ni(OH)2, NaHSiO3, CoOHCI, К2SO3.
Відповідь: 145 і 72,5 г/моль; 93 і 46,5 г/моль;
100 г/моль; 111,5г/моль; 79 г/моль.
3. Обчисліть молярну масу еквівалентів H2S для такої реакції: Н2S + NaOH ® NaHS + H2O. Відповідь: 34 г/моль.
4. Обчисліть молярну масу еквівалентів Cu(OH)2 для реакції: Cu(OH)2 + HCI ® CuOHCI + H2O. Відповідь: 98 г/моль.
5. Чи однакова кількість молярних мас еквівалентів і молярних об¢ємів еквівалентів міститься відповідно: а) у 230 г натрію і 200 г кальцію; б) у 33,6 л водню і у 28 л кисню.
Відповідь: а) так, по 10 молярних мас еквівалентів;
б) ні, 3 і 5 молярних об¢ємів еквівалентів відповідно.
6. Визначте фактори еквівалентності, еквіваленти і молярні маси еквівалентів всіх речовин, які беруть участь у реакції:
AI2O3 + 6HCI ® 2AICI3 + 3H2O
Відповідь:1/6, 1/6 AI2O3, 17 г/моль; 1, HCI, 36,5 г/моль;
1/3,1/3 AICI3, 44,5 г/моль; 1/2, 1/2Н2О, 9 г/моль.
7. Мідь утворює два оксиди, в одному з яких масова доля міді 88,9%, а в другому – 80%. Визначте молярні маси еквівалентів міді в обох оксидах.
Відповідь: 64 г/моль, 32 г/моль.
8. Для розчинення 8,4 г металу потрібно 7,35 г сірчаної кислоти (реакція протікає з повним витисненням водню з сірчаної кислоти). Визначте молярну масу еквівалентів металу і об¢єм водню, який виділяється.
Відповідь:56 г/моль; 1,68 л.
9. 2,6 г гідроксиду металу обробили сірчаною кислотою і
одержали 5,7 г сульфату.Визначте молярну масу еквівалентів металу. Відповідь: 8,74 г/моль.
10. 0,35 г двовалентного металу витиснули з кислоти 209 мл водню, який збирали при 20 0С і тиску 102,3 кПа. Визначте молярну масу еквівалентів металу і молярну масу металу. Який це метал? Відповідь: 20 г/моль, 40 г/моль, Са.
3. БУДОВА АТОМА
Мета вивчення теми:
- засвоїти основи теорії будови атома (основні ідеї квантової механіки, апарат квантових чисел електронів в атомі, принцип Паулі, правило Хунда, правила Клечковського, будова оболонок багатоелектронних атомів) ;
- складати електронні формули і графічні схеми електронних конфігурацій атомів і їх валентних оболонок у стаціонарному і збудженому станах.
Відповідно до сучасних уявлень атом являє собою складну систему з позитивно зарядженого ядра і електронів, що рухаються навколо нього, зв'язаних силами електричної взаємодії. У ядрі сили ядерної взаємодії утримують разом протони, кожний з яких несе один позитивний елементарний заряд, і електрично нейтральні нейтрони. Величина заряду ядра дорівнює (в одиницях елементарного заряду) числу протонів і, відповідно, числу електронів у нейтральному атомі. Ця величина визначає порядковий номер у періодичній системі і тим самим – хімічну індивідуальність кожного елемента.
Корисно зрозуміти і запам'ятати взаємозв'язок основних фізичних характеристик – мас m і зарядів q – складаючих атом частинок з іншими хімічними константами:
mp » mn » 1/ NA = 1/ 6,02×1023 = 1,67×10-24 г = 1,67×10-27 кг.
mē = 1/1840 × mp = 9,1×10-28 г = 9,1×10-31 кг.
|qē | = | qp| = F/NA = 96500 / 6,02×1023 = 1,60×10-19 Кл.
Тут: NA= 6,02×1023 моль-1– число Авогадро; F = 96500 Кл/моль – число Фарадея (заряд одного моля електронів).
Розмір атома за порядком величини дорівнює 10-8см = =0,1нм = 1Å. Розмір ядра приблизно в 105 разів менший розміру атома, однак у ядрі зосереджено понад 99,95 % всієї атомної маси.
Стан електрона в атомі підкоряється законам квантової механіки, яка вивчає рух і взаємодію мікрочастинок. За уявленнями квантової механіки мікрочастинки мають хвильову природу, а хвилі мають загальні властивості із частинками. Це означає, що будь-який мікрооб'єкт поводиться і як локалізована частинка, і як розмита по простору хвиля. Ця властивість називається корпускулярно-хвильовим дуалізмом (подвійністю). Динамічні перемінні, що характеризують частинки (енергія Е и імпульс p = mv, де v – швидкість) і хвилі (довжина хвилі l і частота n) пов'язані через постійну Больцмана h (h = 6,63×10-34 Дж×с): E = h×n,
l = h/р.
Не можна одночасно точно визначити положення в просторі й імпульс (швидкість) мікрочастинки. Цей факт визначається співвідношенням невизначеностей Гейзенберга:
Dх × Dр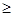 h/2p ,
h/2p ,
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ ДО ПРАКТИЧНИХ РОБІТ З ЗАГАЛЬНОЇ ХІМІЇ
МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ... ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ЕКВІВАЛЕНТИ ПРОСТИХ ТА СКЛАДНИХ РЕЧОВИН
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов