рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Медицина
- /
- Давление насыщенного пара растворителя
Реферат Курсовая Конспект
Давление насыщенного пара растворителя
Давление насыщенного пара растворителя - раздел Медицина, Стоматология Давление Пара Над Раствором Нелетучего Вещества В Каком-Либо Растворит...
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля (I закон), относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
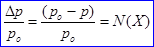 , где
, где
Þ 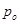 -давление пара над чистым растворителем, Па;
-давление пара над чистым растворителем, Па;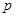 - давление пара растворителя над раствором нелетучего вещества, Па; /
- давление пара растворителя над раствором нелетучего вещества, Па; /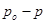 /– абсолютное понижение давления пара над раствором, Па. Величина
/– абсолютное понижение давления пара над раствором, Па. Величина 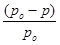 - относительное понижение давления пара над раствором.
- относительное понижение давления пара над раствором.
Þ 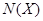 - молярная доля растворенного вещества (Х), которая определяется по формуле:
- молярная доля растворенного вещества (Х), которая определяется по формуле: 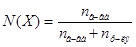 , где
, где 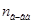 - число молей растворенного вещества;
- число молей растворенного вещества; 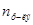 - число молей растворителя. Величина
- число молей растворителя. Величина 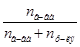 – мольная доля растворенного вещества.
– мольная доля растворенного вещества.
Þ Число молей растворенного вещества и растворителя можно находить по формулам: 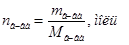 или
или 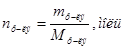 .
.
Þ Отсюда можно найти: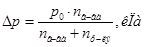 и
и 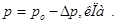
Таким образом, относительное понижение давления пара растворителя над раствором (или депрессия раствора) зависит только от концентрации раствора, но не зависит от температуры. Для разбавленных растворов 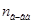 по сравнению
по сравнению 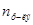 мало и поэтому его величиной в знаменателе уравнения:
мало и поэтому его величиной в знаменателе уравнения: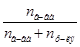 можно пренебречь и тогда закон Рауля примет вид:
можно пренебречь и тогда закон Рауля примет вид: 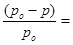
 .
.
Закон Рауляточно соблюдается только для идеальных растворов и приближенно для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному.
2.2. Температура кипения и замерзания растворителя и раствора(II закон Рауля)
Изучая кипение и замерзание растворов, Рауль (1882) установил, что повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорционально моляльности растворов.Эта закономерность называется вторым законом Рауля и его математическим выражением являются уравнения:
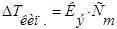
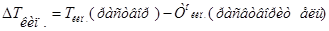
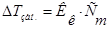
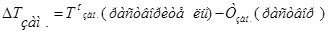
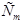 - моляльность раствора;
- моляльность раствора;
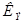 - эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);
- эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);
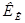 - криоскопическая постоянная растворителя (от греч. «криос» - холод);
- криоскопическая постоянная растворителя (от греч. «криос» - холод);
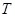 - температура кипения и замерзания раствора;
- температура кипения и замерзания раствора;
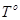 – температура кипения и замерзания чистого растворителя.
– температура кипения и замерзания чистого растворителя.
Постоянные константы 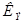 и
и 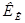 не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Справочные значения констант
не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Справочные значения констант 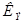 и
и 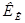 для некоторых растворителей приведены в таблице (см. приложение 6).
для некоторых растворителей приведены в таблице (см. приложение 6).
На измерениях температур кипения и замерзания основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ:
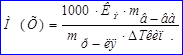
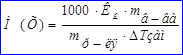
Второй закон Рауля иногда называют следствием первого. Ряд ученых подразделяют все закономерности, установленные Раулем на три закона:
1. тоноскопический (понижение давления пара над раствором);
2. криоскопический (понижение температуры замерзания раствора);
3. эбуллиоскопический (повышение температуры кипения раствора).
В целом, обобщенные формулы для разбавленных растворов электролитов и неэлектролитов имеют вид:
 Для растворов неэлектролитов Для растворов неэлектролитов
| Для растворов электролитов |
1. 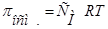 2.
2. 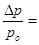 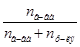 3.
3. 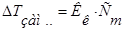 4.
4. 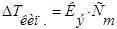
| 1. 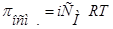 2.
2. 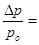 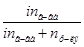 3.
3. 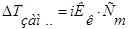 4.
4. 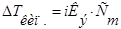
|
Задача №1. Применение соединений цинка в медицине основано на том, что цинк дает соединения с белками – альбуминаты растворимые и нерастворимые, последние обычно образуют пленку на тканевой поверхности и оказывают подсушивающее действие, что способствуют заживлению тканей, а растворимые оказывают действие от слабовяжущего до резко прижигающего. Осмотическое давление 0,1 М. ZnSO4 при 0°С равно 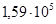 Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Решение.
1. Для растворов электролитов применяем формулу: 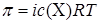 , из которой находим изотонический коэффициент:
, из которой находим изотонический коэффициент: 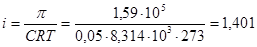 .
.
2. Соль 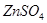 при диссоциации образует 2 иона (К=2).
при диссоциации образует 2 иона (К=2).
3. Согласно (3) 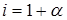 , отсюда
, отсюда 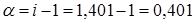 или
или 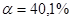 .
.
Ответ.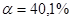 .
.
Задача №2. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18°С изотоничен с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаCI2 в растворе при указанной температуре составляет 65,4%.
Решение.
1. Согласно (1) и (2) 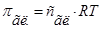 , а
, а 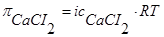 .
.
2. Так как оба раствора изотоничны, то 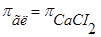 .
.
3. При диссоциации молекулы соли 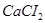 образуется 3 иона (К=3),
образуется 3 иона (К=3), 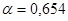 .
.
4. Согласно формуле (3): 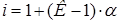
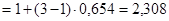 . Следовательно,
. Следовательно, 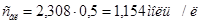 .
.
Ответ.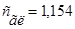 моль/л.
моль/л.
Задача №3. В медицине раствор формальдегида применяется для консервации анатомических и биологических препаратов и не может быть назначен внутрь, т.к. является протоплазматическим ядом. Определить температуру кипения раствора, содержащего 6 г формальдегида 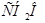 в 100 г воды.
в 100 г воды. 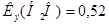 град∙кг/моль.
град∙кг/моль.
Решение.
1. Согласно закону эбулиоскопии(Рауля): 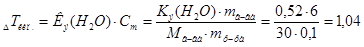 град.
град.
2. Тогда 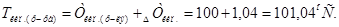
Ответ. 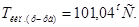
Задача №4.По фармакологическим свойствам этиловый спирт относится к веществам наркотического действия. Воздействуя на кору головного мозга, он вызывает характерное алкогольное возбуждение, в больших дозах – ослабление возбудительных процессов коры и угнетение деятельности дыхательного центра. При какой примерно температуре будет замерзать 40 % водный раствор 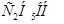 .
.
Решение.
1. Из формулы закона криоскопии (Рауля): 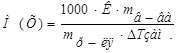 , следует:
, следует: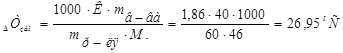
2. Отсюда: 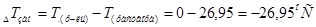 .
.
Ответ.Раствор начнет замерзать примерно при 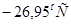 .
.
1.2. Ситуационные задачи №№5, 6, 7,8 для закрепления материала (выполнить в протокольной тетради).
Задача №5. В медицинской практике для компенсации больших потерь крови больному вводят физиологический раствор. Рассчитайте массовую долю (в %) NaCI (с точностью до целых) в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1 г/см3).
Задача №6. С медицинской целью камфору применяют натуральную правовращающую, добываемую из камфорного дерева, либо синтетическую левовращающую, полученного из пихтового масла, либо рацемическую. Криоскопическая постоянная камфоры равна 40,27 оС. 0,0113 г фенантрена понизили точку замерзания 0,0961 г камфары на 27,0 оС. Найдите молярную массу фенантрена в камфоре.
Задача №7.В медицинской практике фруктозуприменяют при лечении белой горячки и американскими учеными предложено ее вводить в состав «отрезвляющих» препаратов, т.к. фруктоза, применяемая в дозе 1 г на кг массы тела одновременно с алкоголем, увеличивает скорость его выведения из организма на 10%, а принимаемая через час – на 20-30%.
Вычислите температуру кипения и замерзания 5% водного раствора фруктозы. 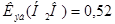 К∙кг/моль,
К∙кг/моль, 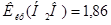 К∙кг/моль.
К∙кг/моль.
Задача №8.Бензол используется для синтеза поверхностно-активных веществ, в том числе большое количество фармацевтических препаратов. Вычислите давление насыщенного пара над раствором бензола (Mr=78 г/моль), в 83 г которого содержится 12,8 г нафталина - С10Н8 (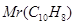 = 128 г/моль), если давлениенасыщенного пара бензола при 20оС равна 100 кПа.
= 128 г/моль), если давлениенасыщенного пара бензола при 20оС равна 100 кПа.
– Конец работы –
Эта тема принадлежит разделу:
Стоматология
Кафедра биохимии... С А Сергеева В Е Рябинин Концентрация растворов Коллигативные...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Давление насыщенного пара растворителя
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов