рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Медицина
- /
- Стоматология
Реферат Курсовая Конспект
Стоматология
Стоматология - раздел Медицина, Гбоу Впо Челгма Минздравсоцразвития России Кафедра Биохимии ...
ГБОУ ВПО ЧелГМА Минздравсоцразвития России
Кафедра биохимии
С.А. Сергеева, В.Е. Рябинин
Концентрация растворов Коллигативные свойства растворовУчебное пособие
предназначено для самостоятельной аудиторной и
внеаудиторной работы студентов, обучающихся
по специальности 060105.65 – Стоматология
Челябинск 2012
УДК
ББК
| Рецензенты: | В. В. Авдин, заведующей кафедрой экологии и природопользования, декан химического факультета ФГБОУ ВПО Южно-Уральского государственного университета, директор НОЦ "Нанотехнологии", профессор, д.х.н. | |
|
Представлены практические задания по избранным разделам неорганической, аналитической и физической химии с учетом физико-химических проблем, имеющих отношение к профессиональной деятельности врача-стоматолога. По каждой изучаемой теме приведены: её содержание, ситуационные задачи с образцами их решения и задания для самостоятельной работы студентов, а также темы реферативных докладов с медико-биологической направленностью. В пособии подробно описаны методики выполнения лабораторных работ, а также физико-химические принципы проведения эксперимента и обработки результатов измерений, что повышает профилизацию предмета. После каждой лабораторной работы приводятся тестовые задания, которые помогут студентам в освоении изучаемой темы. В конце пособия приведены справочные данные о свойствах важнейших неорганических соединений.
Пособие составлено с учетом требований Федерального Государственного образовательного стандарта высшего профессионального образования по специальности 060201– Стоматология, утвержденного приказом Минобрнауки РФ № 16 от 14 января 2011 года.
Учебное пособие утверждено на заседании Ученого совета ГБОУ ВПО ЧелГМА Минздравсоцразвития России от ….12 протокол №…..
Учебное пособие предназначено для студентов стоматологического факультета.
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта без ссылки на издание запрещается.
Сергеева С.А., Рябинин В.Е., 2012
Изд-во «Челябинская государственная
медицинская академия, 2012
Оглавление
| Введение……..……………………………………………………………… Раздел 1.Общие вопросы выполнения лабораторных работ…………….. 1.1. Правила работы в химической лаборатории……….................................. 1.2. Техника безопасности……………….…………………….......................... 1.3. Лабораторный журнал……….…………………………………...……….. Раздел 2. Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа.……......................................................... 2.1.Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями…………………………………………………….….….. 2.2.Ситуационные задачи для закрепления материала………………….…... 2.3.Контрольные вопросы …………………………………………………...... 2.4.Лабораторная работа. Кислотно-основное титрование (нейтрализация)…………………………………………………………...... 2.5.Тесты текущего уровня…………………………………………………….. Раздел 3.Коллигативные свойства растворов неэлектролитов и электролитов………….………………………………………………………… 3.1.Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями………………………………………………………..….. 3.2.Ситуационные задачи для закрепления материала…………………….... 3.3.Контрольные вопросы …………………………………………….………. 3.4.Лабораторная работа. Определение молярной массы неэлектролита криоскопическим методом ………………………………………………... 3.5.Тесты текущего уровня…………………………………………….………. Раздел 4. Протолитические равновесия и процессы. Водородный показатель. Гидролиз солей………….……………………………………….. 4.1.Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями……………………………………………………...….… 4.2.Ситуационные задачи для закрепления материала……………….……... 4.3.Контрольные вопросы ………………………………………………….…. 4.4.Лабораторная работа. Факторы, влияющие на гидролиз веществ...….. 4.5.Тесты текущего уровня…………………………………………….………. Раздел 5. Буферные системы, классификация и механизм действия………………………………………………………………………..... 5.1. Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями…..……………………………………….……………. 5.2. Ситуационные задачи для закрепления материала…………….…..…... 5.3. Контрольные вопросы ……….…………………………………………… 5.4. Лабораторная работа. Определение буферной ёмкости ацетатного буферного раствора по кислоте и щелочи……………………………….. 5.5. Тесты текущего уровня………………………….…………………..……. Приложения ……..…………………………………………….…………. Список литературы ………………………………………………….. |
Введение
Ежедневная практическая деятельность врачей, как правило, не требует использования ими фундаментальных или прикладных знаний химии, так как основывается на отработанных протоколах лечения, инструкциях по применению лекарственных средств и пр., которые в свое время были разработаны с применением в том числе законов и принципов общей и неорганической химии. В то же время, любой выход врача за пределы рутинной практики при попытке создания новых методов или средств лечения, при желании творческого осмысления лечебного процесса, в большей или меньшей степени сопряжен с необходимостью мобилизации базовых сведений из области химии. Именно поэтому изучение основ химии является объективно необходимым элементом подготовки современного врача.
Настоящее учебное пособие к лабораторному практикуму по химии является важным этапом при изучении таких основных понятий как «концентрация растворов», «коллигативные свойства растворов», «водородный показатель», «гидролиз солей», «буферные растворы» и др. Знание способов выражения концентрации растворов, умение готовить растворы определенной концентрации, окажется полезным при изучении других химических дисциплин, биохимии, гигиены, фармакологии, токсикологии и др.
Важное место в пособии уделяется вопросам регуляции различных биологических процессов. При этом необходимым становится усвоение таких понятий, как «осмос», «осмотическое давление», «гипо-, гипер– и изотонические растворы», «осмолярная и осмоляльная концентрация» и др. Приобретение системных знаний о механизмах электролитической диссоциации, водородном показателе (рН), гидролизе солей и буферных системах является необходимым условием для последующего усвоения принципов регуляции метаболизма человека в норме и при возникновении патологических состояний.
Для более эффективного усвоения знаний в пособии разработана учебная карта занятий, включающая практическую часть с решением ситуационных задач и соответствующим контролем, экспериментальную часть и решение тестов для контроля усвоения темы.

Общие вопросы выполнения лабораторных работ
Выполнение лабораторного практикума является обязательным при изучении химии, так как приобретаются навыки научного эксперимента и развивается исследовательский подход к изучению дисциплины.
Правила работы в химической лаборатории
1. На рабочем столе должно находиться только то, что необходимо для выполнения данной лабораторной работы: лабораторный журнал, методическое… 2. В течение всего времени работы рабочее место студента должно содержаться в… 3. Вся химическая посуда в химической лаборатории обязательно должна иметь надписи:название вещества или раствора,…Техника безопасности
2. Студенты, нарушающие правила по технике безопасности, удаляются из лаборатории. Для дальнейшего прохождения практикума они должны пройти… 3. Работа студента в лаборатории разрешаетсятолько во время, отведенное… 4. Работать в лаборатории можно только в халате.В лаборатории запрещается принимать пищу, громко разговаривать, слушать музыку через наушники, заниматься посторонними делами.
7. Для проведения опыта не следуетрасходоватьреактивов больше требуемого по методике количества. Если же случайно взяли избыток реактива, то эти… 8. Запах вещества определяют, направляя его пары к себе движением руки, не… 9. Ни в коем случае нельзя пробовать вещества на вкус!!!Для набора в пипетку любых жидкостей следует использовать только грушу.
15. При разливе кислоты следует обработать это место содой, после чего хорошо промыть водой. 16. Растворы, не подлежащие сливу в канализацию (органические растворители,… 17. Соблюдать правила работы с электрическими приборами (бани, плитки, центрифуги, сушильные шкафы). Нагревать…Меры оказания первой помощи при несчастных случаях
21. В химической лаборатории имеется аптечка и растворы для оказания первой помощи при несчастных случаях (см. таблицу 1.1).
Таблица 1.1
Правила оказания первой помощи пострадавшим в химической лаборатории
Окончание таблицы 1.1
ПРАВИЛА ВЕДЕНИЯ ЛАБОРАТОРНОГО ЖУРНАЛА
2. В лабораторном журнале обязательно указывается дата выполнения работы и название работы. 3. Не следуетпереписывать методику, но все наблюдения, уравнения реакций,… 4. В лабораторном журнале нельзя ничего стирать, заклеивать, выдирать листы, в случае ошибки следует ненужное…В конце каждой работы должны содержаться выводы.
6. Регулярное ведение лабораторного журнала по описанным выше правилам оценивается определенным числом баллов в конце семестра.



Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
Актуальность темы. Растворы представляют для биологии и медицины особый интерес, так как все важнейшие биологические жидкости (гиоплазма, кровь, лимфа, моча, спинномозговая и ротовая жидкость и др.) являются водными растворами солей, белков, углеводов и липидов. Усвоение пищи, транспорт метаболитов, большинство биохимических реакций в живых организмах также протекают в растворах. Именно этим обусловлено широкое использование лекарственных препаратов в виде их водных растворов. Наконец, само происхождение жизни связывается с морем.
Биологические жидкости условно подразделяют на внутриклеточные и внеклеточные (плазма, лимфа, слюна), водно-солевой баланс, которых определяется не только концентрацией ионов и органических соединений, но и работой физиологических систем (почки, легкие, ЖКТ). Таким образом, одной из важнейших характеристик биологических жидкостей является концентрация компонентов (концентрационный гомеостаз), величина которой определяет нормальное или патологическое состояние организма. Поэтому экспериментальное определение концентраций биологических жидкостей или растворов разнообразных лекарственных средств является важной стадией клинических и фармакологических исследований. При этом использование методов нейтрализации является наиболее распространенным, преимущество которых заключается в небольшой трудоемкости в совокупности с достаточной точностью получаемых результатов.
В целом, знание способов выражения концентрации растворов, умения приготовления растворов определенной концентрации необходимо студентам для изучения биохимии, гигиены, фармакологии, особенно наркологии и токсикологии, а врачам – стоматологам всего профиля (включая знания специфики судмедэкспертизы) для правильной интерпретации данных лабораторного анализа, расчета дозировок лекарственных препаратов.
Цель темы:Определение количество растворенного вещества, используя различные способы выражения концентрации. Знакомство с общими приемами титриметрии, приготовлением и стандартизацией титранта, применением кислотно-основных индикаторов, получение навыков измерения объемов с заданной точностью, отбора аликвот, осуществления процесса титрования.
Исходный уровень. При изучении данного материала студенты опираются на знания химии довузовского этапа: «Растворы, растворимость веществ, тепловые эффекты при растворении. Влияние различных факторов на растворимость. Способы выражения концентрации веществ в растворе. Теория электролитической диссоциации Аррениуса (ТЭД). Химические реакции и закономерности их протекания».
Основные учебно-целевые вопросы:
Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
Растворы (определение, классификация).
2.1.Механизм процессов растворения. Термодинамический подход к процессу растворения.
2.2. Растворимость газов в жидкостях. Закон Генри-Дальтона. Растворимость газов в крови. Кессонная болезнь.
2.3. Способы выражения концентрации растворов (массовая, мольная и объемная доли растворенного вещества, молярная концентрация, молярная концентрация эквивалента, титр раствора).
2.4. Взаимосвязь разных способов выражения концентрации растворов.
Титриметрический метод анализа (понятие и виды).
3.1.Расчеты в титриметрии. Закон эквивалентов.
3.2.Оборудование титриметрического анализа: мерные и вспомогательные менее точные посуды. Техника работы в объемном анализе (наблюдение за правильностью установки мениска при работе с пипеткой, мерной колбой и бюреткой, правила наливание раствора пипеткой, проверка емкости мерной посуды).
Метод кислотно-основного титрования (определение, основное уравнение).
4.1. Ацидиметрия и алкалиметрия: исходные вещества и рабочие тированные растворы; кривые титрования, скачок титрования, точка эквивалентности; индикаторы и интервалы их перехода: метилоранж, фенолфталеин, принцип выбора индикаторов для титрования.
4.2. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами.
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть(лабораторная работа).
3. Контроль усвоения темы(тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7)с алгоритмами их решений, эталонами ответов и с комментариями
Расчет по массовой доле веществ в растворе
Задача №1. В медицине издавна борную кислоту /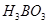 / (сассолин) применяют в виде 2-3% растворов для полоскания горла, в мазях и присыпках, т.к. она обладает антисептическими свойствами. Но, в настоящее время в связи с выявленными побочными явлениями внесены ограничения к ее применению. Сколько граммов
/ (сассолин) применяют в виде 2-3% растворов для полоскания горла, в мазях и присыпках, т.к. она обладает антисептическими свойствами. Но, в настоящее время в связи с выявленными побочными явлениями внесены ограничения к ее применению. Сколько граммов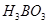 и воды нужно для приготовления 250 г раствора с массовой долей борной кислоты 3%?
и воды нужно для приготовления 250 г раствора с массовой долей борной кислоты 3%?
Решение.
1. Из формулы расчета массовой доли: 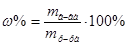 следует:
следует: 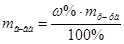
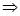
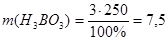 г.
г.
2. Чтобы рассчитать массу воды, нужно из общей массы раствора вычесть массу растворенного вещества: 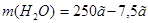 =242,5 г.
=242,5 г.
Ответ.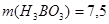 г.,
г., 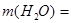 242,5 г.
242,5 г.
Расчеты при разбавлении и смешивании растворов с различной массовой долей растворенного вещества
Задача №2.Натрия нитрит /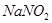 / в весьма редких случаях применяют внутрь при отравлении цианидами. В этом случае его вводят внутривенно в виде 1-2 % раствора. Какую массу воды следует добавить к 50 г раствора
/ в весьма редких случаях применяют внутрь при отравлении цианидами. В этом случае его вводят внутривенно в виде 1-2 % раствора. Какую массу воды следует добавить к 50 г раствора 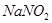 с массовой долей 11%, чтобы получить раствор с массовой долей 1% (0,01)?
с массовой долей 11%, чтобы получить раствор с массовой долей 1% (0,01)?
Решение.
1. Для расчета массы 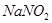 в исходном растворе воспользуемся формулой для расчета массовой доли:
в исходном растворе воспользуемся формулой для расчета массовой доли: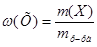 , преобразованной относительно m(X):
, преобразованной относительно m(X): 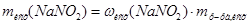 =
=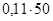 г = 5,5 г.
г = 5,5 г.
2. Найдем массу раствора, которую нужно получить. При добавлении воды масса растворенного вещества не изменяется, следовательно, масса нового раствора в соответствии с вышеуказанной формулой, преобразованной относительно 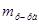 , имеет вид:
, имеет вид: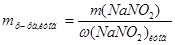 =
=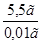 =550 г.
=550 г.
3. 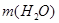 , которую следует добавить, равна разности между массой приготовленного раствора и массой исходного раствора:
, которую следует добавить, равна разности между массой приготовленного раствора и массой исходного раствора: 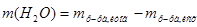 =
=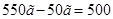 г.
г.
Ответ. 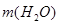 =500 г.
=500 г.
Расчет по молярной концентрации раствора
Задача №3.В медицине калия хлорид /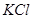 / применяется при нарушении сердечного ритма, особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами K+. Сколько граммов
/ применяется при нарушении сердечного ритма, особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами K+. Сколько граммов 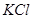 необходимо для приготовления 1 л раствора с
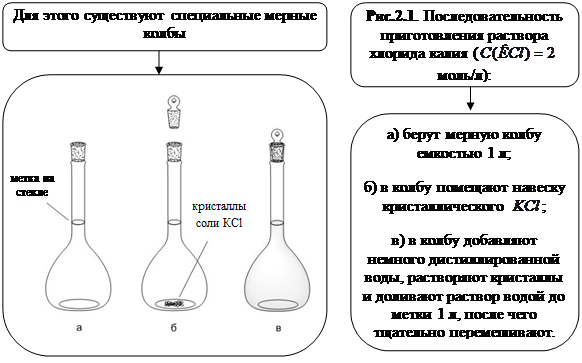
необходимо для приготовления 1 л раствора с 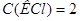 моль/л? Опишите процесс приготовления этого раствора (см. рисунок 2.1).
моль/л? Опишите процесс приготовления этого раствора (см. рисунок 2.1).
Решение.
1. Из формулы расчета молярной концентрации:  следует:
следует: 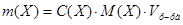
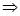
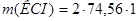 =149,12 г.
=149,12 г.
Ответ. 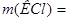 149,12 г.
149,12 г.
2. Приготовление растворов заданной концентрации

Расчет по молярной концентрации эквивалента
Задача №4. Перманганат калия /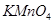 / применяют в медицинской практике как антисептическое средство наружно в водных растворах для промывания ран, полоскания полости рта и горла, а также для смазываний язвенных и ожоговых поверхностей. Рассчитайте сколько граммов
/ применяют в медицинской практике как антисептическое средство наружно в водных растворах для промывания ран, полоскания полости рта и горла, а также для смазываний язвенных и ожоговых поверхностей. Рассчитайте сколько граммов 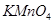 необходимо взять для приготовления 2 л раствора с С(
необходимо взять для приготовления 2 л раствора с С(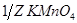 )= 0,5 моль/л, если анализ будет проводиться в кислой среде?
)= 0,5 моль/л, если анализ будет проводиться в кислой среде?
Эталон решение.
1. Из формулы расчета молярной концентрации эквивалентов: 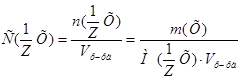 вытекает:
вытекает: 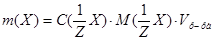 .
.
2. Таким образом, 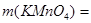
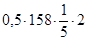 =6,53 г.
=6,53 г.
Ответ. 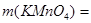 6,53 г.
6,53 г.
Связь между разными способами выражения концентрации
Задача №5.Вычислите молярную, эквивалентную молярную и моляльность раствора серной кислоты с 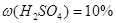 и
и 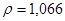
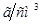 .
.
Решение.
1. Из формулы перехода от концентрации, выраженной массовыми долями растворенного вещества: 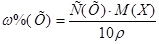 , к молярной концентрации вещества или молярной концентрации эквивалента вещества соответственно вытекает:
, к молярной концентрации вещества или молярной концентрации эквивалента вещества соответственно вытекает: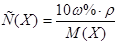 или
или 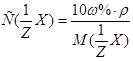 .
.
2. Согласно вышеуказанным формулам получаем:  =
=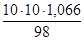 =
=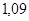 моль/л;
моль/л; 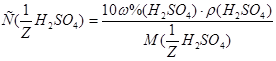 . С учетом того, что
. С учетом того, что 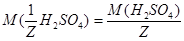 =
= 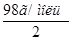 = 49 г/моль, получаем:
= 49 г/моль, получаем: 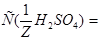
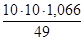 = 2,18 моль/л. Как видно, для перехода от молярной концентрации вещества к молярной концентрации его эквивалента надо знать только значение фактора эквивалентности
= 2,18 моль/л. Как видно, для перехода от молярной концентрации вещества к молярной концентрации его эквивалента надо знать только значение фактора эквивалентности 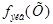 , которое показывает, во сколько раз молярная концентрация эквивалента вещества больше молярной концентрации вещества.
, которое показывает, во сколько раз молярная концентрация эквивалента вещества больше молярной концентрации вещества.
3. Для определения моляльности раствора сначала найдем массу 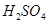 в воде массой 1 кг:10:90=х:1000;
в воде массой 1 кг:10:90=х:1000;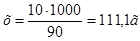 . Отсюда
. Отсюда 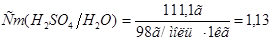 моль/кг.
моль/кг.
Ответ. 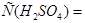
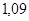 моль/л;
моль/л; 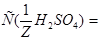 2,18
2,18  ;
; 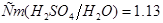 моль/кг.
моль/кг.
Расчет для приготовления растворов лекарственных препаратов при введении больному
Задача №6. Больному при угнетении дыхания и кровообращения различного происхождения необходимо ввести 100 мг лекарственное средство 4-этил-4-метил-2,6-пиперидиндион (бемегрида). Сколько мл этого раствора с массовой долей 0,5% необходимо ввести больному?
Эталон решение.
1. Исходные данные: 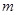 (бемегрида)= 100 мг= 0,1 г., ρ=1 г/мл.
(бемегрида)= 100 мг= 0,1 г., ρ=1 г/мл.
2. Из формул: 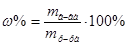 ,
, 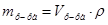 ,
, 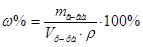 , следует:
, следует: 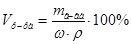 =
= мл (или 20 см3).
мл (или 20 см3).
Ответ.Больному надо ввести 20 мл бемегрида.
Вычисления по результатам прямого титрования
Задача №7.В медицине кислоту хлористоводородную разведенную применяют внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока и ее обычно назначают совместно с препаратами железа, так как она способствует улучшению их всасывания. Какова молярная концентрация эквивалента и титр хлороводородной кислоты, если на нейтрализацию 20 мл ее раствора по реакции 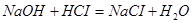 израсходовано 30 мл раствора гидроксида натрия С
израсходовано 30 мл раствора гидроксида натрия С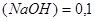 моль/л
моль/л
Эталон решение.
1. Из формулы закона эквивалентов: 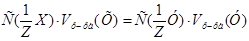 , следует:
, следует: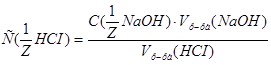 =
= 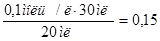 моль/л.
моль/л.
2. Определяем титр раствора HCI по формуле: 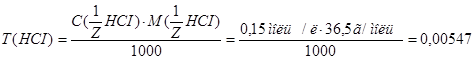 г/мл.
г/мл.
Ответ. 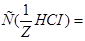 0,15 моль/л;
0,15 моль/л; 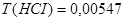 г/мл.
г/мл.
1.2. Ситуационные задачи (№№ с 8 по 16)для закрепления материала (выполнить в протокольной тетради).
Задача №8.Больному массой 59 кг необходимо ввести раствор NaHCO3 из расчета 0,66 ммоль/кг. Сколько мл раствора с массовой долей 4,2% необходимо взять?
Задача №9. Для лечения гнойных ран, а также для полосканий и смазываний при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина) фармацевтом был приготовлен раствор из 5 мл 30% раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе (ρ=1 г/мл).
Задача №10. Фармакопейным препаратом перекиси водорода является раствор перекиси водорода, содержащий 2,7-3,3 % Н2О2 и этот препарат готовят из более концентрированного раствора, содержащего 27,5-31,0% Н2О2 называемого пергидролем. Рассчитайте массу Н2О2 и объем воды, необходимые для приготовления 100 г 3% раствора Н2О2.
Задача № 11. Сколько миллилитров 30% (ρ=1,15 г/мл) раствора соляной кислоты надо взять для приготовления 0,5 л 8,4% фармакопейного препарата HCI (ρ=1,041 г/мл)?
Задача №12.Раствор Люголя, применяющийся в ЛОР- практике для смазывания слизистой оболочки полости рта и горла, содержит 17 мл воды, 1 г йода, 2 г йодида калия. Рассчитать массовые и молярные доли йода и йодида калия в растворе Люголя.
Задача №13. Какую массу глюкозы необходимо растворить в воде массой 260 г, чтобы получить раствор, моляльность которого Сm (С6H12O6/H2O)= 0,5 моль/кг?
Задача №14. Растворы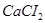 в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция /
в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция /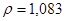
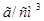 / потребуется для приготовления 20 мл 2% раствора /
/ потребуется для приготовления 20 мл 2% раствора /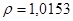
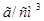 /. Рассчитать молярную долю, молярную, эквивалентную молярную концентрацию и титр полученного раствора.
/. Рассчитать молярную долю, молярную, эквивалентную молярную концентрацию и титр полученного раствора.
Задача №15. Для стандартизации раствора хлороводородной кислоты навеску буры (Na2B4O7∙10H2O) массой 0,256 г растворили в мерной колбе объемом 100 мл. На титрование затрачено 13,16 мл раствора HCl. Вычислите молярную концентрацию эквивалента раствора хлороводородной кислоты.
Контрольные вопросы и задачи
1. Что такое раствор? Какие свойства воды делают ее универсальным растворителем?
2. Какими энергетическими эффектами сопровождается процесс растворения веществ?
3. Что называется парциальным давлением газа? Дайте формулировку закона парциальных давлений Дальтона.
4. Объясните характер изменения растворимости газов в жидкостях при изменении парциального давления газов и температуры системы. Приведите примеры. Что такое кессонная болезнь (для ответа см. приложение 2 и 3).
5. Дайте определение, укажите размерность и обозначение каждого из следующих типов концентраций: молярная концентрация, эквивалентная молярная концентрация (нормальность), моляльность (мольно-массовая концентрация).
6. В чем заключается сущность процесса титрования? Что такое точка эквивалентности?
7. Для чего при титровании применяются индикаторы? Какие индикаторы вы знаете?
8. Рассчитайте молярную массу эквивалента для серной кислоты, фосфорной кислоты, гидроксида калия, сульфата алюминия, карбоната натрия, хлорида меди (II), сульфата меди (II).
9. Какой массы медный купорос 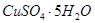 надо добавить к раствору объемом 0,5 л, в котором массовая доля
надо добавить к раствору объемом 0,5 л, в котором массовая доля 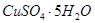 4% (ρ=1,040 г/мл), для того, чтобы увеличить ее до 16%?
4% (ρ=1,040 г/мл), для того, чтобы увеличить ее до 16%?
10. Какая масса кристаллогидрата 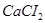
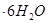 потребуется для приготовления раствора массой 1750 г, если его моляльность должна быть равна 0,2 моль/кг?
потребуется для приготовления раствора массой 1750 г, если его моляльность должна быть равна 0,2 моль/кг?
11. Определить молярную концентрацию эквивалента и титр раствора пероксида водорода, если на титрование 5,0 мл этого раствора израсходовалась 6.5 мл 0,0208 М раствора КMnO4.
Экспериментальная часть
Лабораторная работа. Кислотно-основное титрование (нейтрализация)
Краткое теоретическое обоснование
Суть, методы и индикаторы метода кислотно-основного титрования
(или упрощенно). Согласно протолитической теории кислот и оснований, эту реакцию в общем виде… , в котором и - соответственно основание и кислота, сопряженные исходным.Таблица 2.1
Экспериментальные данные и результаты измерений
Примечание:Стандартизированный раствор может быть использован в свою очередь как вторичный стандартный раствор для определения количества соляной… Опыт №2. Определение массовой доли соляной кислоты в фармакопейном… Цель работы.Опытным путем определить в % содержание соляной кислоты в фармакопейном препарате (ρ = 1,04 г/мл). …Таблица 2.2
Экспериментальные данные и результаты измерений
3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).Образец теста
1) кессонной (декомпрессионной) болезнью 2) базедовой болезнью 3) анемиейI. Информационный раздел
На судебно-химическую экспертизу доставлена: моча пострадавшего, которая лишь один раз подвергалась клинико-лабораторному исследованию.
Обстоятельства дела. Пациент в течение 5 лет по медицинским показаниям в соответствии с назначением врача принимал комбинированный противокашлевый и отхаркивающий препарат «Коделак» по 1 таблетке 3 раза в день и назначение препарата обосновано хроническим заболеванием, доза соответствует терапевтическим. Лекарственный препарат «Коделак» в 1 таблетке содержит 8 мг кодеина.В соответствии официальному электронному документу МЗ РФ«Государственному реестру лекарственных средств» высшая разовая терапевтическая доза кодеина для взрослых составляет 0,05 г (50 мг) на 1 прием, а суточная – 0.2 г (200 мг). Следует учесть, что при приеме внутрь препаратов содержащих кодеин, происходит его трансформация в организме в морфин (один из метаболитов) и конечная концентрация этих веществ, обнаруживаемая в крови и моче зависит от индивидуальных генетических особенностей организма и функции внутренних органов. Кодеин и морфин относятся к одной фармакологической группе соединений – опиатам, т.е. производным морфина.
Информация (заключение экспертов). Из материалов следствия: результаты освидетельствования на состояние наркотического опьянения пострадавшего показали наличие в его моче кодеина в концентрации 6450 нг/мл и морфина в концентрации 1848 нг/мл. Следуя логике экспертов, указанные концентрации могут быть обнаружены в моче чрез 2-3 часа после одномоментного приема 11 таблеток «Коделака» (90 мг кодеина). В рамках наркологической экспертизы, количество выпитых пациентом таблеток препарата «Коделак» эксперты определили по нижеуказанной таблице 2.3, составленной в ходе проведения эксперимента с участием всего трех здоровых испытуемых.
В таблице приведена концентрация кодеина и морфина (в нг/мл) в моче для трех человек, принявших разовую дозу кодеина 90 мг. Оба соединения в моче детектируются в течение 3 дней (72 часа).
Таблица 2.3
Концентрация кодеина и морфина в моче у 3-х испытуемых
II. Аналитический раздел
При решении задачи следует обосновать свой выбор ответа
2. Можно ли считать правильным заключение экспертов, в рамках наркологической экспертизы ссылаясь только на табличные цифровые данные? 3. Возможно ли обнаруженные в моче алкалоиды группы опия – морфин и кодеин в… 4. Правильно ли, что употребление в терапевтических дозах указанного препарата может привести человека к состоянию…Рекомендуемый библиографический список к пункту №4
2. Веселовская, Е.В. Наркотики. Свойства, действие, фармакокинетика, метаболизм: пособие для работников наркологических больниц, наркодиспансеров,… 3. Калетина, Н.И. Токсикологическая химия. Метаболизм и анализ токсикантов:… 4. Линг Луис Дж. Секреты токсикологии. /Л. Дж Линг, Р.Ф. Кларк, Т.Б. Эриксон и др. Пер. с англ.– М.–СПб.:…Неэлектролитов и электролитов
Более того, изучение данной темы необходимо для понимания многих других патологических процессов: нарушение водного и ионного баланса, патология…Вода как универсальный биологический растворитель.
Коллигативные свойства растворов (определение, виды).
2.2. Гипо–, гипер– и изотонические растворы, их значение для медицины. 2.3.Закон Вант-Гоффа (формулировка), уравнение для неэлектролитов и… 2.4. Изотонический коэффициент Вант-Гоффа, его связь со степенью диссоциации.Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть(лабораторная работа).
3. Контроль усвоения темы(тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 4)с алгоритмами их решений, эталонами ответов и с комментариями.
Задачи на закон Вант-Гоффа и Рауля
Краткое теоретическое обоснование
Коллигативными свойствами разбавленных растворов являются: Þ осмотическое давление; Þ понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара…Осмос, осмотическое давление и осмотические явления в биологических системах
Давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем (для крови это вода), отделенным от него…Распределение воды и некоторые факторы ее регуляции
Регуляция водного баланса поддерживает постоянство общего объема жидкости в организме между водными пространствами и секретами организма. Факторы… Осмотическое давление крови человека довольно постоянно и при температуре 310…Таблица №3.1
Суточный баланс воды в организме взрослого человека
Онкотическое давление– это часть осмотического давление, создаваемое за счет содержания крупномолекулярных соединений (белков плазмы) в растворе,… Для количественного изучения осмотического давления применяют специальные…Таблица №3.2
Состав растворов Рингера –Локка и Тироде для теплокровных животных
| Название раствора | Ингредиенты, г/л воды | ||||||
| 
| 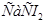
|  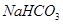
| 
| 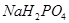
| глюкоза | |
| Рингера-Локка | 9,0 | 0,42 | 0,24 | 0,15 | - | - | - |
| Тироде | 8,0 | 0,2 | 0,2 | 1,0 | 0,1 | 0,05 | 1,0 |
Раствор Рингера—Локка имеет более «физиологический» состав, чем изотонический раствор NaCI, но, однако из-за отсутствия коллоидов (белков) все эти растворы неспособны на длительное время задерживать воду в сосудистом русле — вода быстро выводится почками и переходит в ткани. Поэтому в клинической практике эти растворы применяются в качестве кровезамещающих лишь в тех случаях, когда отсутствуют коллоидные растворы. Важнейшей составной частью плазмы являются белки плазмы: альбумины, глобулины и фибриногены, содержание которых составляет 7—8% от массы плазмы.
Наблюдение явлений плазмолиза и гемолиза эритроцитов (см. рисунки 3.1 и 3.2)
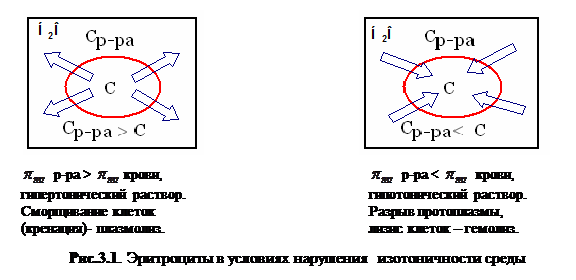
Плазмолиз–это сжатие и сморщивание оболочки клетки, так как в результате экзоосмоса вода диффундирует из клетки в плазму/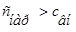 ,
,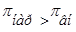 /. Например, если внутривенно ввести раствор, гипертонический по отношению к крови, то вследствие экзоосмоса эритроциты будут обезвоживаться и сморщиваться.
/. Например, если внутривенно ввести раствор, гипертонический по отношению к крови, то вследствие экзоосмоса эритроциты будут обезвоживаться и сморщиваться.
Гемолиз –это разрыв оболочки эритроцитов и выход гемоглобина в плазму, т.к. в результате эндосмоса /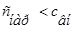 ,
,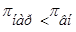 / вода диффундирует в клетку. Например, если внутривенно ввести раствор, гипотонический по отношению к крови, то наблюдается "осмотический шок" и вследствие эндоосмоса может произойти разрыв эритроцитарных оболочек и выход гемоглобина в плазму, благодаря чему кровь приобретает лаковый цвет. В результате концентрация гемоглобина в крови растёт, а общее количества циркулирующих эритроцитов при этом снижается (гемолитическая анемия). Начальная стадия гемолиза происходит при местном снижении осмотического давления до 360-400 кПа (3,5-3,9 атм. или 0,42—0,48%), а полный гемолиз при 260-300 кПа (2.5-3,0 атм. или 0,30— 0,34%).
/ вода диффундирует в клетку. Например, если внутривенно ввести раствор, гипотонический по отношению к крови, то наблюдается "осмотический шок" и вследствие эндоосмоса может произойти разрыв эритроцитарных оболочек и выход гемоглобина в плазму, благодаря чему кровь приобретает лаковый цвет. В результате концентрация гемоглобина в крови растёт, а общее количества циркулирующих эритроцитов при этом снижается (гемолитическая анемия). Начальная стадия гемолиза происходит при местном снижении осмотического давления до 360-400 кПа (3,5-3,9 атм. или 0,42—0,48%), а полный гемолиз при 260-300 кПа (2.5-3,0 атм. или 0,30— 0,34%).

Расчетные формулы
I. Закон и изотонический коэффициент Вант-Гоффа
Где: Þ – концентрация растворенного вещества; Þ Т – температура раствора 0оС (273 К);II. Давление пара разбавленных растворов. Закон Рауля
Давление насыщенного пара растворителя
, где Þ -давление пара над чистым растворителем, Па;- давление пара… Þ - молярная доля растворенного вещества (Х), которая определяется по формуле: , где - число молей…Контрольные задачи
2. Изотоничны ли растворы мочевины и уксусной кислоты с массовой долей 0,6%, если степень диссоциации уксусной кислоты равна 0,01, ρ =1 г/мл? … 3. Магния сульфат // в медицинской практике применяют как слабительное,… 4. Никотинамид (пиридин-3-карбоновой кислоты) в медицинской практике применяют как специфическое противоаллергическое…Экспериментальная часть
Лабораторная работа. Определение молярной массы неэлектролита
Криоскопическим методом
Криоскопический метод является более точным, чем эбуллиоскопический, так как в этом случае не происходит потери растворителя путем испарения,… Цель работы.Научиться методом криоскопии определять молярную массу… Приборы и оборудование: криометр, дифференциальный термометр Бекмена, термометр химический.Таблица №3.1
Экспериментальные данные и результаты измерений
3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).Образец теста
1) положительный 2) отрицательный 3) физиологичныйВопросы по теме для самостоятельного изучения их студентами.
2. Диализ - практическое применение явления диффузии в медицинских исследованиях. 5. Практические навыки, которыми должен овладеть студент по теме занятия.… - вычисление осмотического давления и изменения температуры кристаллизации и кипения растворов для прогнозирования и…Электролиты сильные и слабые.
1.1.Степень и константа диссоциации (ионизации) слабых электролитов. Закон разведения Оствальда.
1.2.Свойства растворов сильных электролитов. Суть теории Дебая и Хюккеля. Ионная сила растворов (I или μ), активность (α), коэффициент активности ионов (γ).
Автопротолиз воды. Ионное произведение воды. Водородный показатель.
2.2. Вывод формул и расчет ,, рН, pOH растворов слабых и сильных кислот и оснований. 2.3. Кислотно-основные индикаторы. Суть теорий индикаторов Оствальда и… 2.4. Принцип колориметрического метода определения рН растворов.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
3.1.Гидролиз солей одно- и многоосновных кислот и одно- и многокислотных оснований (уравнение в молекулярном и ионном виде, рН среды, вывод константы гидролиза (Кг) и связь ее с константой диссоциации слабого электролита, образующегося при гидролизе).
Водно-электролитный баланс организма. Слюна как раствор электролитов. Значение рН биологических жидкостей.
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть(лабораторная работа).
3. Контроль усвоения темы(тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1-по 8)с алгоритмами их решений, эталонами ответов и с комментариями
Вычисление степени и константы электролитической диссоциации
Задача 1.Чему равна степень электролитической диссоциации уксусной кислоты в водном растворе с 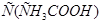 = 0,01 моль/л? Константа диссоциации уксусной кислоты
= 0,01 моль/л? Константа диссоциации уксусной кислоты 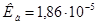 .
.
Решение.
1. Запишем уравнение диссоциации уксусной кислоты в водном растворе и константу электролитической диссоциации:
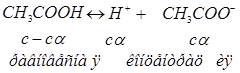
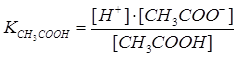
Как видно, из задачи, концентрации всех частиц, образующихся при диссоциации, могут быть определены через исходную концентрацию вещества /с/ и степень электролитической диссоциации /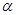 /:
/:
 |
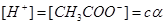
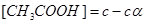
2. Выражение константы диссоциации примет вид: 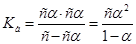 . Так как электролит слабый (<<1), то выражение упрощается:
. Так как электролит слабый (<<1), то выражение упрощается: 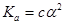 или
или .
.
3. Подставляя данные, получим: 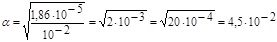 или 4,5%.
или 4,5%.
Ответ. 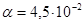 или 4,5%.
или 4,5%.
Вычисление ионной силы и коэффициента активности ионов
Задача 2. Вычислите ионную силу раствора, содержащего в 1 л 0,005 моль нитрата меди 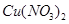 и 0,001 моль сульфата алюминия
и 0,001 моль сульфата алюминия 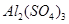 .
.
Эталон решение.
1. Зная, что 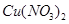
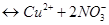 и
и 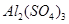
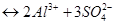 , ионную силу раствора вычисляем по формуле, предложенной Г.Н. Льюисом и М. Ренделом (1921 г):
, ионную силу раствора вычисляем по формуле, предложенной Г.Н. Льюисом и М. Ренделом (1921 г): 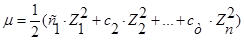 . Таким образом,
. Таким образом, 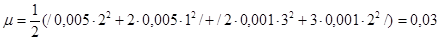 .
.
Ответ. 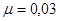
Вычисление концентрации ионов H+ и OH-
Задача 3. При добавлении к воде раствора гидроксида калия /КОН/ концентрация гидроксид- ионов стала равной 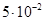 моль/л. Вычислите молярную концентрацию ионов водорода
моль/л. Вычислите молярную концентрацию ионов водорода 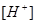 , если температура раствора 40оС.
, если температура раствора 40оС.
Решение.
1. По таблице 5.1. находим величину 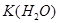 при 40оС, отсюда
при 40оС, отсюда 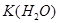 =
=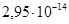 . Обратить внимание!!!Если в задаче не указана температура, то ее принимают равной 25оС, а при этом
. Обратить внимание!!!Если в задаче не указана температура, то ее принимают равной 25оС, а при этом 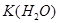 =
=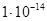 .
.
2. Вычислим концентрацию ионов 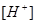 :
:
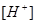 =
=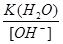 =
=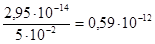 , или
, или 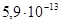 моль/л.
моль/л.
Ответ.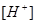 =
=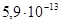 моль/л.
моль/л.
Задача 4.Во сколько раз увеличится активность и концентрация ионов H+ при нагревании воды от 18 до 80оС?
Решение.
1. По таблице №5.1. находим величины константы ионного произведения при 18 и 80оС: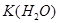 (при 18оС)=
(при 18оС)=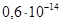 ,
, 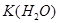 (при 18оС)=
(при 18оС)= 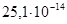 .
.
2. 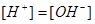 при 18оС =
при 18оС =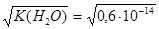
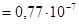 моль/л.
моль/л.
3. 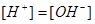 при 80оС =
при 80оС =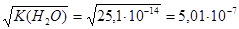 моль/л.
моль/л.
4. Сопоставляя концентрации ионов Н+ и ОН- при 18оС с концентрациями при 80оС, находим на сколько раз увеличится активность и концентрация ионов Н+: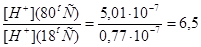 раз.
раз.
Ответ.При повышении температуры активность и концентрация ионов Н+увеличивается 6.5 раз.
Вычисление рН растворов по известной концентрации H+- ионов
Задача 5. В биохимическом анализе используется 0,001 моль/л раствор HCl Определите рН этого раствора.
Решение.
1. Сильные электролиты в водных растворах дислоцируют полностью: 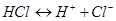 , поэтому .
, поэтому . 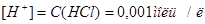 .
.
2. По концентрации ионов 
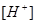 находим рН раствора:
находим рН раствора: 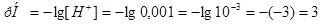 .
.
Ответ. 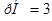 . Значение рН
. Значение рН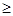 1 указывает на то, что в клиническом анализе используется слабая кислота.
1 указывает на то, что в клиническом анализе используется слабая кислота.
Вычисление молярной концентрации ионов водорода [H+] по известной их рН
Задача 6.Вычислить [H+] в ротовой жидкости, если рН=8,3.
Решение.
1. Рассчитаем 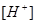 для ротовой жидкости:
для ротовой жидкости: 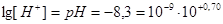 .
.
2. По таблице антилогарифмов находим значение: 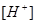 =
=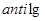 [9-0,700]=
[9-0,700]=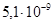 моль/л.
моль/л.
Ответ. 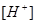 =
=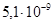 моль/л.
моль/л.
Вычисление рН растворов сильных и слабых электролитов по известной их молярной концентрации
Задача №7. Определите рН раствора 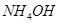 , в котором
, в котором 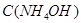 =0,1 моль/л (
=0,1 моль/л (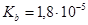 ).
).
Эталон решение.
1. Гидроксида аммония считается слабым электролитом, поэтому для неё применим закон Оствальда: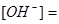
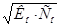 =
=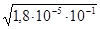 =
=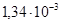 моль/л.
моль/л.
2. Далее возможны два пути решения: а) через ионное произведение воды, или через показатель ионного произведения воды /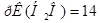 /.
/.
а) 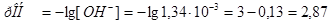 .
.
б) 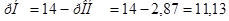
Ответ. 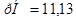 .
.
Вычисление константы и степени гидролиза солей
Задача 8. Вычислите константу и степень гидролиза 0,1 М раствора no первой ступени.
Эталон решение.
1. Первая ступень гидролиза 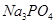 выражается уравнением:
выражается уравнением:
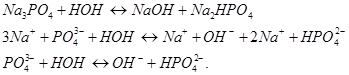
2.  Из уравнения закона действия масс выведем уравнение константы химического равновесия:
Из уравнения закона действия масс выведем уравнение константы химического равновесия: 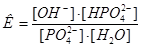 , а из него выведем константу гидролиза:
, а из него выведем константу гидролиза: 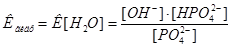
3. Из ионного произведения воды находим, что: 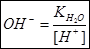 .
.
4. Подставив выражение для 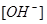 в уравнение константы гидролиза и зная, что:
в уравнение константы гидролиза и зная, что: 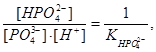 находим:
находим: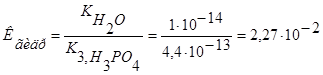 .
.
5. Для вычисления степени гидролиза воспользуемся формулой: 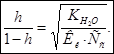 Поскольку величина
Поскольку величина 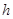 большая, то вычисления будем вести по полной формуле:
большая, то вычисления будем вести по полной формуле: 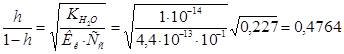
6. Следовательно,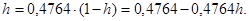 Таким образом,
Таким образом, 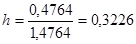 или 32,26%.
или 32,26%.
Ответ.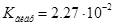
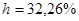
1.2. Ситуационные задачи (№№ с 9 по 19)для закрепления материала (выполнить в протокольной тетради).
Задача №9. Вычислите степень и константу ионизации муравьиной кислоты, если концентрация ионов водорода в 0,2 М растворе муравьиной кислоты равна 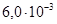 моль/л.
моль/л.
Задача №10.Для устранения условного рефлекса на алкоголь назначают 1% (ρ= 1 г/мл) раствор сульфата меди. Вычислите активность ионов меди в таком растворе (Т=298 К) и определите, сколько мг 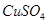 содержится в шприце объемом 1 мл.
содержится в шприце объемом 1 мл.
Задача №11.Каковы ионная сила и активность ацетилсалициловой кислоты (аспирина) в растворе концентрации 0,01 моль/л, если константа диссоциации равна 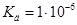 ?
?
Задача №12..Вычислите концентрацию ионов водорода и гидроксида для следующих растворов: а) мочи (рН=6,0) б) ротовой жидкости (рН=6,39); в) крови (рН=7,34) г) желудочного сока (рН=0,9).
Задача №13. Вычислите концентрацию ионов 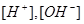 и величину
и величину 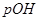 , если в центре долек клетка печени
, если в центре долек клетка печени 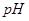 = 6,8.
= 6,8.
Задача №14.Определить концентрации 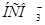 и
и 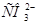 в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
Задача №15. При отравлении 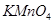 , который является сильным окислителем, используют восстановитель -
, который является сильным окислителем, используют восстановитель -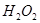 .Однако в препарате
.Однако в препарате 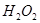 возможна избыточная кислотность, вызванная либо способом получения ее, либо добавлением в качестве консерванта кислот, поэтому ГФ устанавливает предел кислотности. Рассчитайте значение рН 3,0%-го водного раствора Н2О2. Плотность раствора принять равной 1 г/см3. Константа кислотной диссоциации пероксида водорода
возможна избыточная кислотность, вызванная либо способом получения ее, либо добавлением в качестве консерванта кислот, поэтому ГФ устанавливает предел кислотности. Рассчитайте значение рН 3,0%-го водного раствора Н2О2. Плотность раствора принять равной 1 г/см3. Константа кислотной диссоциации пероксида водорода 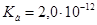 ,
, 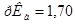 .
.
Задача №16. Для корреляции кислотно-щелочного равновесия при алкалозе используют 5% раствор аскорбиновой кислоты (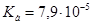 ;
; 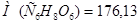 г/моль;
г/моль; 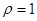 г/см3). Определите рН данного раствора.
г/см3). Определите рН данного раствора.
Задача №17. Определите рН раствора 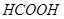 , в котором
, в котором  =0,1 моль/л (
=0,1 моль/л (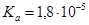 ) и раствора
) и раствора 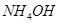 , в котором
, в котором 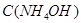 =0,2 моль/л (
=0,2 моль/л (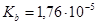 ).
).
Задача №18.Определите, как изменится рН водного раствора формиата натрия с концентрацией С(HCOONa) = 0,10 моль/л, если раствор разбавить водой в 10 раз. 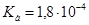 ,
, 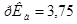 .
.
Задача №19. Рассчитайте константу гидролиза 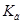 , степень гидролиза
, степень гидролиза 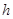 и рН 0,05 М раствора
и рН 0,05 М раствора 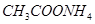 .
. 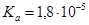 ,
,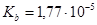 .
.
Контрольные вопросы
1. В чем заключается основная причина диссоциации? Как зависит способность электролитов к диссоциации от вида химической связи?
2. Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты?
3. Что такое константа диссоциации? Чем она отличается от степени диссоциации и от чего зависит?
4. Что называют активной концентрацией или активностью? В каком соотношении она находится с аналитической концентрацией?
5. Что называют ионной силой раствора, и чем она определяется? Как изменяется ее значение с увеличением числа различных ионов, присутствующих в растворе, с увеличением заряда и концентрации каждого иона?
6. Почему в результате гидролиза изменяются кислотно-основные свойства среды? Как ее можно определить?
7. Дистиллированная вода в открытых сосудах со временем показывает слабокислую среду (рН=6). Как объяснить это явление?
Экспериментальная часть
Лабораторная работа. Факторы, влияющие на гидролиз веществ
Цель работы.Экспериментально определить влияние различных нижеуказанных факторов на степень гидролиза солей и доказать его ступенчатый характер, а также определить природу конечного продукта гидролиза.
Оборудование: набор пробирок в штативе, спиртовки, спички, держатели для пробирок.
Реактивы:растворы – хлорида, ацетата, сульфита и карбоната натрия; сульфата алюминия; карбоната аммония; хлорида висмута; фенолфталеина; концентрированная соляная кислота; дистиллированная вода; универсальная индикаторная бумага.
Опыт №1. Определение характера среды при гидролизе солей с помощью универсальной индикаторной бумаги
Ход работы:
1. В 5 чисто вымытые пробирки налейте по 2-3 мл растворы, указанных в нижеследующей таблице. Опустите в эти растворы полоски универсальной индикаторной бумаги, полученные окраски сравните с цветной шкалой и с рН дистиллированной воды.
2. Результаты внесите в таблицу № 4.1.
Таблица 4.1
Реакция среды при гидролизе солей
Опыт №2. Влияние температуры на степень гидролиза
1. Налейте в пробирку 2-3 мл 1 М раствора ацетата натрия, добавьте 1-2 капли фенолфталеина. Нагрейте раствор почти до кипения и наблюдайте появление… 2. Выводы.Составьте уравнения гидролиза соли и объясните с позиций принципа Ле… Опыт №3. Влияние разбавления и увеличения концентрации ионов на равновесие гидролиза висмута (III) хлоридаОпыт №4. Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза
1. Налейте в пробирки по 1-2 мл 1 М раствора сульфита и карбоната натрия. В каждую пробирку добавьте по одной капле фенолфталеина. 2. Выводы. Почему окраска фенолфталеина в этих растворах различна? Объясните…Опыт №5. Полный (необратимый) гидролиз
1. Внесите в пробирку 6-8 капель сульфата алюминия и столько же карбоната натрия . Отметьте выделение пузырьков и выпадение осадка гидроксида… 2. Выводы.Почему не получилось карбоната алюминия? Какие соли подверглись… 3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).Образец теста
1) сильный 2) слабый 3) слабыйВопросы по теме для самостоятельного изучения их студентами.
4.2. Роль гидролиза в жизни природы и в процессах жизнедеятельности живых организмов. Предотвращение гидролиза в практике приготовления лекарств и… 5. Практические навыки, которыми должен овладеть студент по теме занятия.… - вычисление активности ионов и ионную силу растворов, рН сильных и слабых электролитов, константы и степени…Состав и свойства слюны
В полости рта образуется смешанная слюна или ротовая жидкость, которая, кроме секретов слюнных желез включает микрофлору и продукты их жизнедеятельности, содержимое пародонтальных карманов, десневую жидкость, десквамированный (слущенный) эпителий, распавшиеся мигрирующие в полость рта лейкоциты, остатки пищевых продуктов и др.
Ротовая жидкость или смешанная слюнапредставляет собой вязкую, слегка опалесцирующую мутноватую жидкость с относительной плотностью 1,001-1,017.
Ротовая жидкость на99,0—99,4 % состоит из 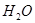
 и 1,0-0,6% растворенных в ней органических и минеральных веществ (см. приложение 12) и меняется в зависимости от свойств, принимаемой пищи, возраста и ряда др. факторов (источника, метода сбора и вида стимулятора парасимпатической или симпатической нервной системой).
и 1,0-0,6% растворенных в ней органических и минеральных веществ (см. приложение 12) и меняется в зависимости от свойств, принимаемой пищи, возраста и ряда др. факторов (источника, метода сбора и вида стимулятора парасимпатической или симпатической нервной системой).
РН слюны
Гидрокарбонатная буферная система обеспечивает 80% буферных свойств слюны и концентрация ее в слюне возрастает прямо пропорционально увеличению… Буферная емкость нестимулированной слюны составляет 4,45-4,65 ммоль/л НСl, а… Дёсневая жидкость образуется в значительно меньшем объеме, чем слюна, и также оказывает влияние на рН ротовой полости.…Буферные системы (определение).
1.2.Уравнения Гендерсона-Гассельбаха (вывод формул). Влияние разведения и концентрирование на величину рН буферов. 1.3. Механизм действия ацетатного и аммонийного буферных систем. 1.4. Буферная ёмкость и факторы, определяющие данную характеристику, методы определения.Кислотно-основное состояние (КОС) крови и ротовой жидкости (понятие о щелочном резерве, ацидозе и алкалозе).
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть(лабораторная работа).
3. Контроль усвоения темы(тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1- по 4)с алгоритмами их решений, эталонами ответов и с комментариями.
Вычисление рН буферного раствора
Задача №1.Три раствора содержат уксусную кислоту /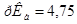 / концентрации 0,10 моль/л и ацетата натрия концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л. Вычислите рН этих растворов.
/ концентрации 0,10 моль/л и ацетата натрия концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л. Вычислите рН этих растворов.
Решение.
1. Расчет рН буферных растворов производится по уравнению Гендерсона-Гассельбаха: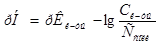 /или
/или 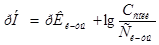 .
.
Подставляем числовые данные и получаем:
а) 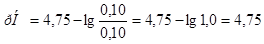 ;
;
б) 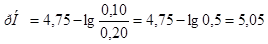 ;
;
в)
Ответ. а)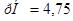 ; б)
; б)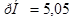 ; в)
; в)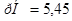 .
.
Вычисление изменения рН буферных растворов, вызванных добавлением кислоты или щелочи
Задача №2.Для экспериментального определения содержания ионов 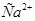 в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. ВычислитерН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония
в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. ВычислитерН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония 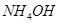 и хлорида аммония
и хлорида аммония 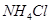 . Как изменится рН при добавлении к 1 л этой смеси 0,1 М
. Как изменится рН при добавлении к 1 л этой смеси 0,1 М 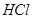 и при добавлении к 1 л этой смеси 0,1 М
и при добавлении к 1 л этой смеси 0,1 М 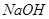 и при разбавлении раствора водой в 10 раз, если
и при разбавлении раствора водой в 10 раз, если 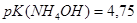 ?Правильно ли приготовлен буферный раствор?
?Правильно ли приготовлен буферный раствор?
Решение.
1. рН исходной смеси растворов 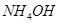 и
и 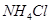 вычислить по формуле:
вычислить по формуле: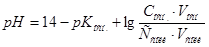 . Следовательно,
. Следовательно, 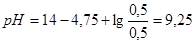 .
.
2. При добавлении к буферному раствору 0,1 М 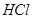
 уменьшится на 0,1 М и станет равной 0,4 М, а С(
уменьшится на 0,1 М и станет равной 0,4 М, а С(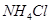 ) возрастет до 0,6 М. Следовательно,
) возрастет до 0,6 М. Следовательно, 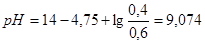 .
.
3. При добавлении же 0,1 М 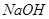 к 1 л смеси
к 1 л смеси 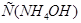 увеличится до 0,6 М, а
увеличится до 0,6 М, а 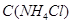 уменьшится до 0,4 М, в результате этого получим:
уменьшится до 0,4 М, в результате этого получим: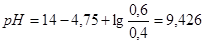 .
.
4. При разбавлении буферного раствора водой в 10 раз будем иметь: 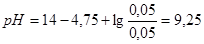 .
.
Ответ. 1) 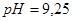 (исходной смеси); 2)
(исходной смеси); 2) 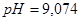 (при добавлении
(при добавлении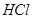 ); 3)
); 3)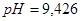 (при добавлении
(при добавлении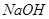 ); 4)
); 4) 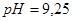 (при разбавлении водой). Буферный раствор приготовлен удовлетворительно, т.к. оптимальная величина рН для определения
(при разбавлении водой). Буферный раствор приготовлен удовлетворительно, т.к. оптимальная величина рН для определения 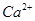 (или
(или 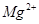 ) около 9.
) около 9.
Вычисление соотношения объемов компонентов буферной системы с определенным рН
Задача №3.Вычислите объем раствора натрий формиата с 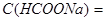 0,1 моль/л и объем муравьиной кислоты
0,1 моль/л и объем муравьиной кислоты 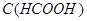 =0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 (
=0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 (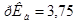 ).
).
Решение.
8. Из формулы расчета рН: 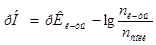 следует:
следует: 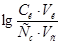
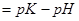 .
.
9. С учетом того, что 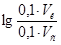
 =0,60, получаем:
=0,60, получаем: 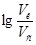 =0,60.
=0,60.
10.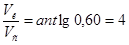 . Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.
. Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.
11. Находим нужный объем кислоты и соли: 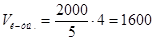 мл,
мл, 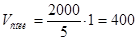 мл.
мл.
Ответ. 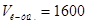 мл;
мл; 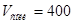 мл.
мл.
Вычисление буферной ёмкости
Задача №4.К 100 мл к ротовой жидкости для изменения рН от 7,8 до 7,4 надо добавить 3,6 мл HCl 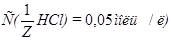 , какова буферная ёмкость
, какова буферная ёмкость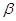 этой жидкости?
этой жидкости?
Решение.
8. Буферную ёмкость 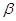 вычисляем по формуле:
вычисляем по формуле:
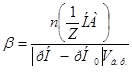 =
=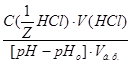 =
=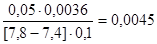 моль/л.
моль/л.
Ответ.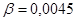 моль/л.
моль/л.
1.2. Ситуационные задачи (№№ с 5 по 14)для закрепления материала (выполнить в протокольной тетради).
Задача №5.Раствор формальдегида способен придавать тканям упругость и поэтому его применяют для консервации анатомических и биологических препаратов. Но при длительном хранении этого раствора происходит окислительно-восстановительная реакция, в результате чего образуются молекулы метилового спирта и муравьиной кислоты. Для нейтрализации кислоты используется фосфатный буферный раствор. Рассчитайте значение рН буферной смеси, содержащей в 1 л раствора 0,10 моль 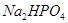 и 0,30 моль
и 0,30 моль 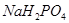 . Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна
. Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна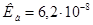 ;
; 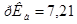 .
.
Задача №6.Каков рН буферного раствора, приготовленного смешением 20 мл 0,2М раствора 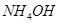 и 50 мл 0,5 М раствора
и 50 мл 0,5 М раствора 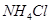 ?
?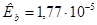 . рКа (СН3СООН)=4,74.
. рКа (СН3СООН)=4,74.
Задача №7.Вычислить рН раствора, полученного путем смешивания 20 мл 0,05 М раствора азотистой кислоты 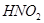 и 30 мл 1,5 М раствора нитрита натрия
и 30 мл 1,5 М раствора нитрита натрия 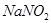 .
.
Задача №8.Определите рН буферного раствора, содержащего в 1 л 0,4 моль муравьиной кислоты и 1,0 моль формиата натрия, до разбавления и после разбавления в 50 раз, если 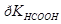 = 3,75.
= 3,75.
Задача №9.Гидрокарбонатная буферная система обеспечивает 80% буферных свойств слюны, а повышенные потери 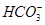 , ограничение выведения
, ограничение выведения 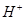 и
и 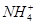 ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный
ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный 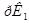 в слюне 6,11?
в слюне 6,11?
Задача № 10.рН ротовой жидкости в норме 5,8-7,5, а при нарушениях кислотно-щелочного равновесия может изменяться в пределах 4,5-8,3. При каких соотношениях количеств 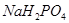 и
и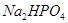 рН ротовой жидкости становится равным: а) 4,5; б) 8,3.
рН ротовой жидкости становится равным: а) 4,5; б) 8,3.
Задача №11.Буферный раствор приготовлен из 50 мл 0,3 М раствора 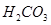 /
/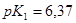 / и 40 мл 0,5 М раствора
/ и 40 мл 0,5 М раствора 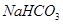 . а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М
. а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М 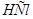 ? в) Рассчитайте буферную емкость по кислоте.
? в) Рассчитайте буферную емкость по кислоте.
Задача №12. К 100 мл ротовой жидкости для изменения рН на единицу надо добавить 1,8 мл 0,2 М раствора HCl. Какова буферная ёмкость ротовой жидкости по кислоте?
Задача №13.Сколько щелочи нужно добавить к 1 мл десневой жидкости, чтобы изменить их рН от 7,9 до 8,3, если буферная ёмкость белкового буфера 0,034 моль/л?
Задача №14.Буферная ёмкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора гидроксида натрия с молярной концентрацией 0,1 моль/л можно добавить к 250 мл этого раствора, чтобы сместить рН не более чем на 0,3 единицы?
Контрольные вопросы и задачи
9. Что выполняет роль слабой кислоты в фосфатном буфере: гидрофосфат или дигидрофосфат?
10. Почему при выводе формул рН буферных растворов равновесную концентрацию слабых электролитов можно принять за исходную?
11. Докажите, что небольшое разбавление практически не влияет на рН буферных систем.
12. Почему максимальная буферная ёмкость наблюдается при соотношении компонентов 1:1?
13. Почему буферная ёмкость по кислоте и по щелочи не всегда совпадает?
14. Какая буферная система вносит максимальный вклад в буферную ёмкость ротовой жидкости и крови?
15. Как используется уравнение Гендерсона–Гассельбаха при оказании помощи пациентам с отравлениями?
16. При введении в раствор формиата аммония: ионов а) 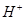 и б)
и б) 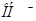 протекают следующие процессы: а)
протекают следующие процессы: а) 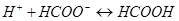 ; б)
; б)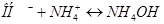 . Будет ли раствор
. Будет ли раствор 
 проявлять буферные свойства?
проявлять буферные свойства?
17. Какое соотношение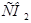 и
и 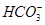 опасно для жизни и зачем в организме создается резерв
опасно для жизни и зачем в организме создается резерв 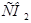 ?
?
18. При подъеме в горы наблюдается гипервентиляция легких. Какое нарушение кислотно-основного гомеостаза при этом возможно?
19. Что такое алкалоз и ацидоз и как изменяется рН при выдохе?
20. Какова должна быть концентрация ацетата натрия в 0,01 М растворе уксусной кислоты, чтобы концентрация ионов 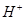 в растворе была равна
в растворе была равна 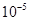 моль/л?
моль/л?
21. Какую из кислот: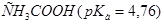 ,
, 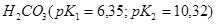 ,
, 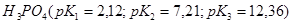 лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов?
лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов?
22. Для приготовления трех буферных растворов использовали 1,0 М растворы гидрофосфата и дигидрофосфата натрия, смешав их в соотношениях: а) 8:2; б)5:5; в) 3:7. У какого раствора будет максимальная буферная ёмкость и наибольшее значение рН?
23. Рассчитайте величину буферной ёмкости фосфатного буферного раствора, если после добавления 10 мл 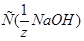 =0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.
=0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.
24. Во сколько раз концентрация водородных ионов в крови (рН=7,36) больше, чем в спинномозговой жидкости (7,53)?
Экспериментальная часть
Лабораторная работа. Определение буферной ёмкости
Ацетатного буферного раствора по кислоте и щелочи
Оборудование: набор пробирок в штативе; бюретки вместимостью 25 мл; воронки диаметром 30 м; колбы конические вместимостью 250 мл ; градуированные… Реактивы: соляная кислота, растворы уксусной кислоты, гидроксида и ацетата… Ход работы:Таблица 5.1
Экспериментальные данные и результаты измерений
7. Выводы. Согласуется ли полученное значение водородной функции с литературными данными? Чем может быть вызвано отклонение, если оно есть?… 3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).Образец теста
1) 2) 3)Вопросы по теме для самостоятельного изучения их студентами.
1. Современные методы определения рН в живой клетке и в биологических жидкостях. Применение ионоселективных электродов для исследования биологических объектов на примере слюны.
Практические навыки, которыми должен овладеть студент по теме занятия.
ПриложениЯ А
Приложения 1
Десятичные приставки к названиям единиц
Приложение 2Парциальное давление и напряжение газов, кПа (мм рт. ст.)
Формулы перехода от одних выражений концентраций растворов к другим
Константы некоторых жидкостей, применяемых в качестве растворителей
Ионное произведение воды при температуре от до : , … Примечание: При повышении температуры от до ионное произведение воды увеличивается в 500 раз, т.е. .Константы диссоциации некоторых слабых электролитов
Характеристика важнейших индикаторов
Приложение 10Средние значения водородного показателя (рН) биологических жидкостей
Расчет в растворах кислот и оснований Сильная кислота: Сильное основание … Приложение 12Состав смешанной слюны человека
Список литературы
Основная литература
1. Попков, В.А. Общая и биоорганическая химия /В.А.Попков, А.С. Берлянд.– М.: Издательский центр «Академия», 2011.-368 с.
2. Слесарев, В.И. Химия: Основы химии живого /В.И. Слесарев.-СПб: Химиздат, 2007. С. 123-152.
3. Беляев, А.П. Физическая и коллоидная химия /А.П. Беляев, В.И. Кучук, К.И. Евстратова и др.- М.: ГЭОТАР – Медиа, 2008. – С. 83-90, 130-139.
4. Попков, В.А.Общая химия /В.А.Попков, С.А. Пузаков. – М.: ГЭОТАР-Медиа, 2007.-С. 240-295.
Дополнительная литература
1. Попков, В.А. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов /В.А. Попков, А.В. Бабков. – М.: Высшая школа, 2006.- С.85-94.
2. Харитонов, Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн.1. Общие теоретические основы. Качественный анализ /Ю.Я. Харитонов.– М.: Высш. шк., 2005.–615 с.: ил.
3. Харитонов, Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн.2. Количественный анализ. Физико-химические (инструментальные) методы анализа /Ю.Я. Харитонов.– М.: Высш. шк., 2005.–559 с.: ил.
4. Калетина, Н.И. Токсикологическая химия. Метаболизм и анализ токсикантов: учебное пособие /Н.И. Калетина.– М.: ГЭОТАР-Медиа, 2008.– 1016 с.
5. Лужников, Е.А. Секреты токсикологии / Е.А. Лужников. Пер. с англ.– М.–СПб.: Издательство «БИНОМ»– Издательство «Диалект», 2006.– 376 с.
6. Государственный реестр лекарственных средств.Официальный электронный документ МЗ РФ(Портал по введению государственного реестра лекарственных средств, официальный сайт МЗСЦ РФ http://grls.rosminzdrav.ru).
– Конец работы –
Используемые теги: Стоматология0.043
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Стоматология
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов