Лекция 2 2. Структурные уровни пространственной организации белков
Лекция 2
Белки
2. Структурные уровни пространственной организации белков.
Белки играют фундаментальную роль в формировании и поддержании структуры и функций живых организмов.
Белки (функции):
- принимают участие в построении клеток и тканей;
- осуществляют биологический катализ;
- регуляторные и сократительные процессы;
- защиту от внешних воздействий.
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
Связи, определяющие и стабилизирующие структуру биополимеров.
При рассмотрении пространственной структуры белков, необходимо, прежде всего, уделить внимание взаимодействиям (силам), стабилизирующим пространственную структуру белков.
Ковалентная (химическая) связь
Химические свойства живых организмов зависят от способности углерода, водорода, азота и некоторых других элементов образовывать ковалентные связи.
В органических соединениях этот тип связи является основным. Ковалентная связь возникает между атомами с относительно малыми различиями в электроотрицательностях, например, С и Н; С и О; С и N;
N и O, которые образуют химическую связь за счет общей электронной пары:

Связь, образованная путем обобществления пары электронов в результате перекрывания атомных орбиталeй связываемых атомов, называется ковалентной.
Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов.
Различают неполярную и полярную ковалентную связь: Неполярная (симметричная) ковалентная связь - связь между атомами с… Например: H-H, Cl-Cl, C-C.Ионные или электростатические взаимодействия.
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью.
Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов: когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион; другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
Атом Na (1 электрон на внешнем уровне) и атом Cl (7 внешних электронов) превращаются в ионы Na+ и Cl- с завершенными внешнимиэлектронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь.
Водородная связь.
Структуру водородной связи мы с вами разберём на примере взаимодействия молекул воды между собой.
Молекула воды является диполем. Это объясняется тем, что атом водорода, связанный с более электроотрицательным элементом кислородом, имеющим неподелённую электронную пару, испытывает недостаток электронов и поэтому способен взаимодействовать с атомом кислорода другой молекулы воды.
В результате этого взаимодействия возникает водородная связь
(Рис. 2.1):
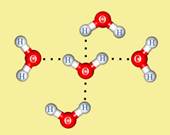
Механизм образования водородной связи между молекулами воды
В результате также возникает водородная связь, которая графически обозначается тремя точками (Рис. ):Гидрофобные взаимодействия
Группы, которые могут образовывать водородные связи с молекулами воды, называются гидрофильными. К этим группам относятся полярные группы: аминогруппа (-NH2),… Как правило, гидрофильные соединения хорошо растворимы в воде. !!! Это обусловлено тем, что полярные группы способны…Рис. 2.3. Механизм образования гидрофобных и гидрофильных взаимодействий
Молекулы или части молекул, неспособные образовывать водородные связи с водой называются гидрофобными группами.
К этим группам относятся алкильные и ароматические радикалы, которые неполярны и не несут электрического заряда.
Гидрофобные группы – плохо или вовсе не растворимы в воде.
Это объясняется тем, что атомы и группы атомов, входящие в состав гидрофобных групп, являются электронейтральнымии (поэтому) не могут образовывать водородных связей с водой.
!!! Гидрофобные взаимодействия возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды.
В результате этого молекулы воды вытесняются на поверхность гидрофильных молекул (Рис. 2.3).
2.1.5. Ван-дер-ваальсовы взаимодействия.
В молекулах существуют также весьма слабые и короткодействующие силы притяжения между электрически нейтральными атомами и функциональными группами.
Это так называемые ван-дер-ваальсовые взаимодействия.
Они обусловлены электростатическим взаимодействием между отрицательно заряженными электронами одного атома и положительно заряженным ядром другого атома.
Так как ядра атомов экранированы окружающими их собственными электронами от ядер соседних атомов, то возникающие между различными атомами ван-дер-ваальсовы взаимодействия весьма невелики.
Все эти типы взаимодействий принимают участие в формировании, поддержании и стабилизации пространственной структуры (конформации) белковых молекул (Рис. 2.4):
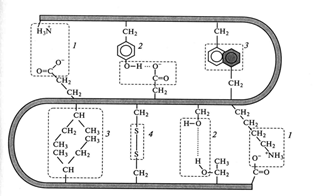
Рис. 2.4. Механизм образования ковалентных связей и слабых нековалентных взаимодействий: 1 - электро-статические взаимодействия; 2 – водородные связи;
3 – гидрофобные взаимодействия, 4 – дисульфидные связи
Силы, которые способствуют формированию пространственной структуры белков и удерживающие её в стабильном состоянии, являются очень слабыми силами. Энергия этих сил на 2-3 порядка меньше энергии ковалентных связей. Они действуют между отдельными атомами и группами атомов.
Однако, огромное число атомов в молекулах биополимеров (белков), приводит к тому, что суммарная энергия этих слабых взаимодействий становится сравнима с энергией ковалентных связей.
Белки
В предыдущей лекции мы с вами говорили о том, что аминокислоты, соединяясь друг с другом посредством пептидных связей, образуют полипетиды.
!!! Белками являются полипетиды, способные образовывать и самостоятельно стабилизировать свою пространственную структуру.
Эта способность приобретается благодаря наличию большого числа слабых нековалентных взаимодействий и связана с числом аминокислотных остатков, образующих полипептидную цепочку.
Как правило, белками называют полипетиды, содержащие более 50 аминокислотных остатков.
Вместе с тем длина полипептидной цепи может достигать до нескольких тысяч остатков аминокислот; молекулярная масса белков колеблется от 6000 до 1 миллиона и более килодальтон.
Уровни структурной организации белковых молекул
Для специфического взаимодействия необходима достаточно "твердая" пространственная структура. Поэтому биологическая функция белков тесно… Знание молекулярной трехмерной структуры белка необходимо для понимания… Поэтому мы с вами сейчас будем говорить структуре, о природе ее стабильности и способности к самоорганизацииПервичная структура белков
Первичная структура белков – последовательность аминокислот в полипептидной цепи (или цепях) и положение дисульфидных связей (если они есть(Рис. 2.6):
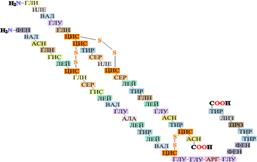
Рис. 2.6. Первичная структура белковой молекулы
Свойства первичной структуры:
1) Последовательность аминокислот в первичной структуре белка является специфической видовой характеристикой данного белка.
2) Первичная структура белка является основой для формирования последующих структур белка за счёт взаимодействия радикалов аминокислотных остатков полипептидной цепи.
Вторичная структура белков
Часто в полипептидных цепях содержатся участки, последовательность аминокислотных остатков которых, образует локально упорядоченные трёхмерные структуры.
Совокупность таких упорядоченных структур называют вторичной структурой белков.
В результате совокупности действия таких факторов, как:
- плоское строение пептидной связи;
- возможность свободного вращения связей у α-углеродного атома
- постоянство углов и межатомных расстояний
формируются следующие типы вторичной структуры белков:
α-спираль, β-структура и β-складка.
Спираль
Рис. 2.7. Вторичная структура белковой молекулы: α-спираль (*) Это — правая спираль, которую можно себе представить в виде пептидной цепи, закрученной вокруг гипотетического…Структура
Рис. 2.8. Вторичная структура белковой молекулы: β-структура. Лист …Изгиб
В области неупорядоченных структур достаточно протяжённые зоны представлены петлями и резкими изгибами.
Наиболее часто встречаются так называемые β-изгибы, когда полипептидная цепь резко меняет своё направление на 180º. Этот изгиб по форме напоминает шпильку для волос и образуется между тремя аминокислотами за счет водородной связи (см. презентацию к лекции). Он необходим для изменения пространственного расположения полипептидной цепи при образовании третичной структуры белка.
!!! Какую именно конформацию принимают участки полипептидной цепи (α-спираль, β‑складку, β-изгиб или остаются неструктурированными) в значительной степени определяется первичной последовательностью полипептидной цепи.
Третичная структура белков
Это объясняется тем, что в результате взаимодействий аминокислотных остатков полипептидной цепи уменьшается свободное вращение связей полипептидного… Ограничение подвижности и тем самым формирование и поддержание третичной…Четвертичная структура белков
Субъединица (протомер) полипептидная цепь, характеризующаяся наличием третичной структуры. Взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки… Субъединицы связаны друг с другом посредством лишь слабых нековалентных взаимодействий (электро-статических,…Рис. 2.13. Строение молекулы миоглобина
Такое сходство связано с тем, что обе молекулы выполняют сходную функцию: связывание и транспорт кислорода. Модель молекулы гемоглобина.
