Коллигативные свойства растворов - раздел Образование, ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ Свойства Растворов, Которые Не Зависят От Природы Растворенных Частиц, А Зави...
Свойства растворов, которые не зависят от природы растворенных частиц, а зависят только от их концентрации, называются коллигативными.
Основной закон, определяющий коллигативные свойства – закон Рауля. Он устанавливает, что относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
 = N или
= N или  =
=  ,
,
 где Р
где Р – давление насыщенного пара над чистым растворителем;
– давление насыщенного пара над чистым растворителем;
Р – давление насыщенного пара над раствором;
N - мольная доля растворенного вещества;
ν , ν
, ν – количество моль растворенного вещества и растворителя.
– количество моль растворенного вещества и растворителя.
Закон Рауля имеет ряд важных следствий:
I. Понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя прямо пропорционально моляльной концентрации растворенного вещества.
 Т
Т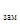 = К
= К С
С = К
= К
 ,
,
где  Т
Т = Т
= Т (растворителя) – Т
(растворителя) – Т (раствора), С
(раствора), С - моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,
- моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,  - масса растворителя, г, К
- масса растворителя, г, К - криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя.
- криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя.
Анализ уравнения показывает, что:
а) водные растворы с одинаковой моляльностью разных нелетучих неэлектролитов замерзают при одинаковой температуре;
б) понижение температуры замерзания растворов с одинаковой моляльностью одного и того же нелетучего неэлектролита в разных растворителях зависит только от химической природы этого растворителя.
II. Повышение температуры кипения раствора по сравнению с температурой кипения растворителя прямо пропорционально моляльной концентрации раствора.
 Т
Т = Е
= Е С
С = Е
= Е
 ,
,
где  Т
Т = Т
= Т (раствора) – Т
(раствора) – Т (растворителя), Е
(растворителя), Е - эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя.
- эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя.
3.Закон Вант-Гоффа: Осмотическое давление в разбавленных растворах неэлектролитов прямо пропорционально молярной концентрации раствора и абсолютной температуре.
Р = С(Х)RT,
= С(Х)RT,
где С(Х) – молярная концентрация вещества Х, моль/л, R – универсальная газовая постоянная (8,314 кПа∙л/моль∙К), Т – температура, К.
Законы Рауля и Вант-Гоффа можно использовать для количественного описания свойств электролитов, если в их выражение ввести поправочный коэффициент i (изотонический коэффициент).
 Т
Т = i К
= i К С
С ;
;  Т
Т = i Е
= i Е С
С ; Р
; Р = i С(Х)RT.
= i С(Х)RT.
Изотонический коэффициент i показывает, во сколько раз число частиц в растворе электролита больше общего числа растворенных молекул. Зная изотонический коэффициент i, можно для данного раствора электролита установить относительную долю молекул, распавшихся на ионы, т.е. степень диссоциации электролитa i = 1 +  (n-1),
(n-1),  =
=
 ,
,
где n – число ионов, образующих молекулу электролита.
Пример 1. Вычислить осмотическое давление при 27 С раствора, в 500 мл которого содержится 20 г сахара.
С раствора, в 500 мл которого содержится 20 г сахара.
Решение: Сахароза С Н
Н О
О – неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению:
– неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению:
Р = С(С
= С(С Н
Н О
О )RT,
)RT,
C(C H
H O
O ) =
) =  =
= = 0,117 моль/л
= 0,117 моль/л
R = 8,314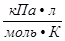 , T = 27+273 = 300 K
, T = 27+273 = 300 K
P = 0,117
= 0,117 ∙8,314
∙8,314 ∙300 = 291,8 кПа
∙300 = 291,8 кПа
Ответ: P = 291,8 кПа
= 291,8 кПа
Пример 2. Давление пара воды 23,8 мм.рт.ст. при 25 С. Каково будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре?
С. Каково будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре?
Решение: Находим количество моль сахара и воды.
М(Н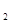 О) = 18 г/моль: n(H
О) = 18 г/моль: n(H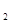 O) =
O) = =
=  = 5 моль
= 5 моль
М(С Н
Н О
О )=342 г/моль: n(C
)=342 г/моль: n(C H
H O
O ) =
) = =
= = 0,05 моль
= 0,05 моль
Используя закон Рауля, находим давление насыщенного пара над чистым растворителем:
P = P (1 -
(1 -  ) = 23,8 (1-
) = 23,8 (1-  ) = 23,56 ( мм. рт. ст.)
) = 23,56 ( мм. рт. ст.)
Ответ: Р = 23,56 мм. рт.ст.
Пример 3. Определить молярную массу глицерина, если 4,4 % раствор его в воде кипит на 0,26 C выше, чем чистая вода.
C выше, чем чистая вода.
Решение: Глицерин является неэлектролитом, поэтому молярную массу находим из формулы  Т
Т = Е
= Е С
С = Е
= Е
 . Откуда,
. Откуда,
М(глицерина) =  =
= 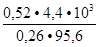 = 92 г/моль.
= 92 г/моль.
Ответ: М (глицерина) = 92г/моль
Пример 4.Раствор, содержащий 25,5 г BaCl 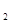 в 750 мл воды, замерзает при - 0,756
в 750 мл воды, замерзает при - 0,756 С. Вычислить кажущуюся степень диссоциации соли.
С. Вычислить кажущуюся степень диссоциации соли.
Решение: BaCl 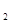
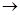 Ba
Ba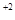 + 2Cl
+ 2Cl - cильный электролит.
- cильный электролит.
Вычисляем понижение температуры замерзания без учета ионизации соли.
 Т
Т = К
= К С
С = К
= К
 ,
,
M (BaCl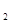 ) = 137+35,5∙2 = 208 г/моль
) = 137+35,5∙2 = 208 г/моль
m (H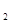 O) = V(H
O) = V(H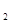 O)
O)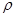 (H
(H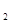 O) = 750 мл ∙1 г/мл = 750 г
O) = 750 мл ∙1 г/мл = 750 г
К (Н
(Н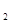 О) = 1,86 К∙кг/моль.
О) = 1,86 К∙кг/моль.
 Т
Т =
=  = 0,3 К , i =
= 0,3 К , i =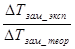 =
=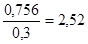 .
.
Из формулы i =1+ (n-1) выражаем
(n-1) выражаем  ,
,  =
= .
.
Ответ:  =0,76 или 76%
=0,76 или 76%
Задания для самостоятельного решения:

 1. 68,4 г сахарозы C12H22O11 растворено в 1000 г воды. Рассчитайте: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 200С равно 2314,9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52
1. 68,4 г сахарозы C12H22O11 растворено в 1000 г воды. Рассчитайте: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 200С равно 2314,9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 , соответственно.
, соответственно.
2. 8 г хлорида натрия растворено в 100 г воды. Рассчитайте: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 200С равно 2314,9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 , соответственно. Изотонический коэффициент хлорида натрия равен 2.
, соответственно. Изотонический коэффициент хлорида натрия равен 2.
3. 6,2 г этиленгликоля С2H4(OH)2 растворили в 500 г воды. Плотность этиленгликоля равна 1,116 г/см3. Рассчитайте: а) относительное понижение давления насыщенного пара растворителя над раствором, б) температуру кипения, в) температуру замерзания, г) осмотическое давление раствора. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 , соответственно.
, соответственно.
4. Какую массу фенола C6H5OH следует растворить в 370 г диэтилового эфира при некоторой температуре, чтобы понизить давление насыщенных паров растворителя с 90 кПа до 75 кПа?
5. Какую массу камфоры C10H16O нужно добавить к 98,5 г бензола, чтобы понизить давление насыщенного пара бензола на 1,91 мм.рт.ст. при 26,10С? При этой температуре давление насыщенного пара чистого бензола составляет 100 мм.рт.ст.
6. Чему равна молярная масса растворенного в 500 г бензола неэлектролита массой 76,1 г, если температура замерзания понизилась с 5,40C до 0,30С? К к, бензол = 5,12 .
.
7. Температура кипения раствора, содержащего 0,6 г антрацена в 10 г хлороформа, повышается на 1,2250 С. Определите молярную массу антрацена, если эбулиоскопическая постоянная хлороформа составляет 3,63 2 .
.
8. Температура замерзания раствора, содержащего 0,244 г бензойной кислоты в 20 г бензола, равна 5,2220 С. Температура замерзания чистого бензола 5,4780 С. Определите молярную массу бензойной кислоты в этом растворе. Чем можно объяснить полученное значение молярной массы бензойной кислоты C6H5COOH? К к, бензол = 5,12  .
.
9. 4 г нафталина растворили в 100 г бензола. Определите молярную массу нафталина, если известно, что в результате растворения температура замерзания растворителя понижается на 1,9320 C. К к, бензол = 5,12  .
.
10. Температура кипения сероуглерода составляет 46,20 C. Раствор, содержащий 0,512 г серы в 10 г сероуглерода, кипит при 46,670 С. Сколько атомов серы входит в состав молекулы серы, растворенной в сероуглероде? К э, сероуглерод = 2,36  .
.
11. Раствор, содержащий ацетон CH3C(O)CH3 (температура кипения 56,30С) массой 100 г и глицерин C3H5(OH)3 массой 2,3 г кипит при 56,730 С. Найдите эбулиоскопическую постоянную ацетона.
12. Известно, что водные растворы этиленгликоля широко применяются в качестве антифризов – растворов с низкой температурой замерзания, которые применяют в системе охлаждения автомобилей. Определите: а) сколько литров этиленгликоля С2H4(OH)2 нужно взять для заполнения автомобильного радиатора, имеющего объем 5 л, чтобы жидкость в нем не замерзала до – 150 С. Плотность этиленгликоля составляет 1,116 г/мл; б) в каком объемном соотношении следует смешать воду и этиленгликоль для приготовления антифриза с температурой замерзания – 250 С; в) при какой температуре будет замерзать такой антифриз, полученный смешением этиленгликоля и воды в равных объемах.
13. В радиатор объемом 10 л поместили равные объемы воды и метилового спирта CH3OH (плотность метанола равна 0,8 г/мл). Чему равна температура замерзания полученного раствора?
14. Водный раствор хлорида натрия с концентрацией 1 моль/л замерзает при температуре – 3,350 С. Вычислите изотонический коэффициент хлорида натрия в этом растворе. Плотность раствора равна 1,04 г/ мл.
15. Раствор, содержащий уксусную кислоту массой 0,571 г в воде массой 100 г, замерзает при температуре – 0,1810 С. Вычислите изотонический коэффициент уксусной кислоты в этом растворе.
16. Гидроксид натрия массой 90 г растворили в 750 мл воды. Приготовленный раствор кипит при 102,650 С. Вычислите изотонический коэффициент гидроксида натрия в этом растворе.
17. Найти изотонический коэффициент гидроксида натрия, если раствор, содержащий 10 г едкого натра в 1 кг воды, кипит при 100,2340 С.
18. Вычислить кажущуюся степень диссоциации хлорида кальция CaCl2 в 0,2М растворе, если осмотическое давление раствора при 270 С составляет 1247,1 кПа.
19. Раствор, содержащий 0,53 г карбоната натрия Na2CO3 в 200 г воды, кристаллизуется при – 0,130 С. Вычислите кажущуюся степень диссоциации соли в данном растворе.
20. При 1000 С давление насыщенного пара растворителя над раствором, содержащим 0,05 моль сульфата натрия Na2SO4 в диссоциации сульфата натрия.
21. При 200 С осмотическое давление водного раствора некоторого неэлектролита равно 4,38∙105 Па. Чему будет равно осмотическое давление, если раствор разбавить в три раза, а температуру повысить до 400 С?
22. Чему равно осмотическое давление раствора с массовой долей глицерина C3H5(OH)3 1% (плотность раствора равна 1,0006 г/мл) при 180С? Будет ли этот раствор изотоничен раствору с осмотическим давлением 500 кПа?
23. Рассчитайте осмотическое давление при 310 К 5%-ного водного раствора глюкозы C6H12O6 (плотность раствора равна 1,02 г/мл) для внутривенного введения при кровопотере. Каким является этот раствор (гипо-, гипер- или изотоническим) по отношению к растворам, имеющим следующие значения осмотического давления: а) 780 кПа (кровь, верхняя граница); б) 730 кПа (кровь, нижняя граница); в) 256 кПа; г) 3048 кПа; д) 1570 кПа?
24. Вычислите молярную массу вещества, если раствор, содержащий 50 г этого вещества в 0,5 л, оказывает на мембрану при 250 С осмотическое давление, равное 7,5 атм.
25. Осмотическое давление водного раствора, содержащего 5 г органического вещества в 250 мл воды, при 200 С равно 300 кПа. Плотность раствора 1,03 г/мл. Определите температуру замерзания этого раствора.
Все темы данного раздела:
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Согласовано
«УТВЕРЖДАЮ»
Инженерная школа ДВФУ
Заведующий кафедрой
общей, неорганической
и элементоорганической химии
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Форма подготовки (очная)
Школа естественных наук ДВФУ
Кафедра общей, неорганической и элементоорганической химии
курс 1 с
Учебно-методического комплекса дисциплины
«Химия»
Учебно-методический комплекс дисциплины «Химия» разработан для студентов 1 курса по специальности 180100.62 – «Кораблестроение, океанотехника и системотехника объе
Annotation
The given Chemistry Courseware is worked out specially for first year students, whose branch of study is construction, university discipline number 180100.62 «Shipbuilding, ocean engineering and sy
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Согласовано
«УТВЕРЖДАЮ»
Инженерная школа ДВФУ
Заведующий кафедрой
общей, неорганической
и элементоорганической химии
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Форма подготовки (очная)
Школа естественных наук ДВФУ
Кафедра общей, неорганической и элементоорганической химии
курс 1 с
Оборотная сторона титульного листа РПУД
I. Рабочая программа пересмотрена на заседании кафедры:
Протокол от «10_____» ____09_____________ 2012 г. № ___1___
Заведующий кафедрой __________
Цели освоения дисциплины
Требования к образованию бакалавров включают определенный минимум знаний в области химии. Данный курс предназначен для подготовки дипломированных бакалавров и ставит своей целью помочь будущим бака
Место дисциплины в структуре ООП бакалавриата
Необходимо отметить, что темпы развития современной науки, и химии в том числе, исключительно высоки: каждые десять лет общий объем научной информации возрастает в три – четыре раза. При этом основ
Начальные требования к освоению дисциплины
Дисциплина «Химия» изучается на базе курса химии средней школы. В связи с этим для освоения курса студент должен знать:
1. Символику химических элементов и устройство периодической системы
Фактический уровень
В результате теоретического изучения дисциплины студент должен знать:
1. Химическую терминологию при описании химических систем;
2. Классификацию элементов, простых и сложных веще
Операционный уровень
В результате практического изучения дисциплины студент должен уметь:
1. Логически верно, аргументировано и ясно строить устную и письменную речь (ОК-2);
2. Уметь записывать уравне
Аналитический уровень
1. Выделять и формулировать химическую проблему или ее аспекты в процессе решения конкретной научно-технической задачи (ОК-10);
2. Интерпретировать полученные результаты термодинамических
Строение вещества
Атомно-молекулярная теория. Основные определения. Моль. Законы стехиометрии. Язык химии.
Строение атома. Ядро и электроны. Атомный номер элемента. Изотопы. Волновые свойства электрона. Ква
Химическая термодинамика, энергетика процесса, кинетика и химическое равновесие
Основные понятия и определения. Гомогенные и гетерогенные системы. Условия существования систем. Термодинамические функции состояния системы. Термодинамический подход к химическим реакциям. Основны
Жидкие системы – растворы
Жидкие системы. Область жидкого состояния. Жидкие растворы. Растворение и растворимость. Общие свойства растворов неэлектролитов. Законы Рауля и Вант-Гоффа. Особенности химических реакций в жидких
Окислительно-восстановительные процессы
Окислители и восстановители. Уравнения реакций окисления-восстановления. Направление реакций. Сила окислителей и восстановителей. Стандартные окислительно-восстановительные потенциалы.
Эле
График изучения дисциплины
Таблица 3
Вид учебных
занятий
№ недели; (кол. часов в неделю); I семестр
Образовательные технологии
В соответствии с требованиями ФГОС ВПО по данному направлению подготовки реализация компетентного подхода предусматривает использование активных и интерактивных форм проведения заня
Учебно-методическое и информационное обеспечение дисциплины
1. Основная литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка; под ред: А.И. Ермакова – 30-е изд., испр. – М.: Интеграл-Пресс, 2009 – 727 с. –
Материально-техническое обеспечение и электронные средства обучения, иллюстрационный материал, специализированное и лабораторное оборудование
1.Специализированная химическая лаборатория, оснащенная приборами, системой вентиляции и лабораторной мебелью.
2. Наборы химических реактивов, необходимых для выполнения лабораторных работ
Перечень типовых экзаменационных вопросов
1. Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Строение и свойства молекул по типу химических связей.
Рейтинговая оценка по дисциплине
Распределение баллов по видам учебных работ
Таблица 4
№ п/п
Виды учебной деятельности студента, учитываемые в рейтинговой оценке
Оц
Тема 1. Строение атома, периодический закон Д.И. Менделеева
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные положения квантовой механики, квантово-механическая модель атома, квантов
Тема 2. Химическая связь
Цели и задачи:
На фактическом уровне получения знаний:
1. Понятие молекулы и иона;
2. Основные положения теории химического строения А.М. Бутл
Тема 1. Межмолекулярное взаимодействие
Цели и задачи:
На фактическом уровне получения знаний:
1. Понятие межмолекулярного взаимодействия и его особенности;
2. Виды межмолекулярных взаим
Тема 2. Агрегатные состояния вещества
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятия твердого, жидкого, газообразного и плазменного, конденсированного, кристаллического и амор
Тема 1. I и II закон термодинамики
Цели, задачи:
На фактическом уровне получения знаний:
1. Термодинамическое описание системы. Классификация систем и термодинамические параметры системы;
Тема 1. Кинетика химических процессов и химическое равновесие
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятие химической кинетики;
2. Методы регулирования скорости химической реакции;
Тема 1. Физико-химические свойства растворов
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные понятия, используемые для описания водных растворов: компонент, фаза, раствор, растворите
Тема 2. Растворы электролитов
Цели, задачи:
На фактическом уровне получения знаний:
1. Электролиты сильные и слабые, кислоты, основания, соли, Изотонический коэффициент;
2. Сам
Тема 1. Коллоидные растворы
Цели, задачи:
На фактическом уровне получения знаний:
1. Коллоидное состояние вещества и основные условия возникновения такого состояния;
2. Класс
Тема 1. Окислительно–восстановительные реакции
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятие эффективного заряда атома в молекуле. Окислители и восстановители. Окислительно–восстанови
Тема 1. I род электродных процессов. Электродные процессы и электродвижущие силы в гальванических элементах.
Цели, задачи:
На фактическом уровне получения знаний:
1. Предмет изучения электрохимии. Электродный потенциал металла, механизм его возникновения, способы
Тема 2. Электролиз
Цели, задачи:
На фактическом уровне получения знаний:
1. Электролиз, как окислительно-восстановительный процесс;
2. Катод и анод, их поляризация о
Тема 3. Коррозия и защита металлов
Цели, задач:
На фактическом уровне получения знаний:
1. Определение процесса коррозии;
2. Виды коррозионных разрушений;
3. Типы коррозион
Тема 1. Полимерные материалы
Цели, задачи:
На фактическом уровне получения знаний:
1. Классификация и номенклатура высокомолекулярных соединений;
2. Методы получения полимеров
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Лабораторный практикум является важной составляющей естественнонаучной дисциплины «Химия» и представлен ла
Определение молярной массы эквивалента металла
Цель работы: познакомиться с газометрическим методом изучения химических реакций на примере определения молярной массы эквивалента металла.
Рекомендации
Методика выполнения опыта
В небольшую пробирку налейте 5 мл разбавленного раствора соляной кислоты при помощи пипетки так, чтобы не смочить кислотой стенки пробирки. Пробирку с кислотой осторожно наклоните и положите навеск
Расчёты и обсуждение результатов
Расчёт Мэ(Ме) можно выполнить двумя способами.
Первый способ:
1. Применив уравнение состояния идеального газа Клапейрона-Менделеева
Комплексные соединения
Цель работы:познакомиться со строением и свойствами комплексных соединений.
Рекомендации:при подготовке к работе повторите химические связи и меха
Опыт 1. Получение комплексных соединений
В две пробирки, согласно варианту работы, налейте по две – три капли вещества, в состав которого входит комплексообразователъ. Затем по каплям добавьте второе вещество до образования осадка и его р
Опыт 2. Разрушение комплексных ионов
К полученному в опыте 2 комплексному соединению (отмечено звездочкой) добавьте реактив (согласно варианту) до изменения окраски.
Таблица 2.2
Данные к опыту 2
Опыт 3. Участие комплексных ионов в реакциях обмена
В пробирку, согласно варианту, внесите две-три капли средней соли. Затем по каплям добавьте комплексного соединения до появления осадка.
Таблица 2.3
Данные к опыту
Опыт 4. Диссоциация комплексных и двойных солей
Возьмите две пробирки. Проведите качественные реакции на наличие и отсутствие в свободном виде в растворе исследуемого вещества центрального иона. Для этого внесите в пробирку по две – три капли ис
Определение теплового эффекта реакции нейтрализации
Цель работы:освоить методику экспериментального определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием.
Рекомендации:
Методика проведения опыта
Тепловой эффект реакции нейтрализации определяется в простейшем калориметре. Объемы исходных веществ приведены в табл.1 согласно варианту.
Таблица 3.1
Объемы исходных веществ
Обработка результатов эксперимента
1. Определите изменение температуры раствора ∆T =Тк – Тн.
2. Рассчитайте количество теплоты Q(Дж), выделившейся в ходе реакции:
Q =(mкис + m
Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции от концентрации реагирующих веществ и температуры.
Рекомендации: познакомьтесь с
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Для исследования предлагается реакция:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O
Опыт 2. Зависимость скорости реакции от температуры
Исследуется полуэмпирическое правило Вант-Гоффа и уравнение Аррениуса, графическое решение которого позволяет определить энергию активации реакции.
Методика выполнения опыта
Гидролиз солей
Цель работы:изучение процесса гидролиза солей разного типа, установление количественных характеристик процесса гидролиза, изучение влияния различных факторов на
Опыт 1. Реакция среды водного раствора соли
Работа выполняется по вариантам (табл.5.1).
Таблица 5.1
Данные к опыту 1
Вариант
Соли
Опыт 2. Влияние различных факторов на степень гидролиза
Опыт 2.1. Влияние разбавления на степень гидролиза
В сухую пробирку внесите с помощью пипетки 10-15 капель насыщенного раствора ацетата натрия и 1 каплю раствора фенолфталеина. Отме
Коллоидные растворы
Цель работы: получить конденсационным методом ряд коллоидных растворов, определить знак коллоидных частиц, провести их коагуляцию.
Краткие теоретические осн
Опыт 2. Получение золя гидроксида железа
Нагрейте в колбочке около 30 мл дистиллированной воды до кипения и прибавьте в кипящую воду по каплям концентрированный раствор хлорида железа (III) до получения раствора устойчивого темно-красного
Опыт 4. Коагуляция золей от действия электролитов
а) в три пробирки налейте одинаковое количество полученного во втором опыте золя гидроксида железа (III) и прилейте в первую пробирку несколько капель раствора хлорида натрия, во вторую – фосфата н
Электрохимические процессы
Цель работы: познакомиться с процессами взаимного превращения химической и электрической энергий.
Рекомендации:повторите теорию ок
Опыт 1. Медно - цинковый гальванический элемент
В два микростакана налить 1М растворы: в первый – раствор ZnSO4 и туда же опустить зачищенный цинковый электрод, во второй – раствор CuSO4 с опущенным в него зачищенным медным
Коррозия металлов
Цель работы: изучение важнейших процессов, протекающих при коррозии металлов.
Контрольные вопросы:
1. Каковы
Опыт 1. Исследование относительной скорости коррозии железа в присутствии различных металлов
Коррозия как процесс самопроизвольный, протекает одновременно по всем возможным механизмам. Микроэлемент может возникнуть в любой точке изделия: достаточно попадания капли раствора на место соприко
Опыт 3. Изучение защитных свойств металлических покрытий. Коррозия оцинкованного и луженого железа
Коррозия металла, защищенного покрытием, начинается при нарушении сплошности покрытия (например, при нанесении глубокой царапины); при этом в контакте с окружающей средой находятся оба металла; и з
Общие свойства металлов
Цель работы: изучить химические свойства металлов – важнейших конструкционных материалов. Оценить химическую устойчивость металлов в различных агрессивных среда
Опыт 3. Действие щелочей на металлы
Испытайте действие щелочей на следующие металлы: алюминий, цинк и медь. Для этого в отдельные пробирки поместите по кусочку названных металлов и прилейте в каждую немного концентрированного раствор
Основы атомно-молекулярного учения
При рассмотрении этой темы основное внимание уделить разделам:
1. Газовые законы;
2. Закон эквивалентов.
Усвоить основные
Закон эквивалентов
Эквивалент fХ - некая реальная или условная частица вещества Х, которая м
Элементы химической термодинамики
Знать:
1.Основные термодинамические функции: теплоту, работу, внутреннюю энергию, энтальпию, энтропию, изобарно-изотермический и изохорно-изотермический потенци
Химическая кинетика
Выучитьпонятия:
1. скорость химической реакции: истинная и средняя
2. константа скорости химической реакции
3. порядок и молекулярность реакции
Способы выражения состава растворов
Растворами называют гомогенные системы, состоящие из двух и более компонентов. Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято называть
Равновесия в растворах электролитов
Электролитами называют вещества, расплавы и растворы которых проводят электрический ток. Неэлектролиты электрический ток не проводят. Электролиты делят на две большие группы: cильны
Модуль 5. Основы электрохимии
Выучить следующие понятия:
1. окислитель, восстановитель, окисление, восстановление;
2. катод, анод;
3. электродный потенциал;
4. ЭДС
Коррозия металлов
Коррозиейназывают процесс самопроизвольного окисления металла в результате его физико-химического взаимодействия с окружающей средой (ΔG < 0). По механизму протекания р
I. Атомно-молекулярное учение
1. Для газов нормальными условиями считаются:
а) 101,3 кПа, 273 К; б) 1 кПа, 00 С; в) 100 Па, 250 С.
2. Значение универсальной газовой постоянной R в междуна
II. Строение атома. Периодическая система
1. Укажите элемент, которому соответствует электронная формула атома
а) Ge; б) Са;
III. Химическая связь
1. Связь, осуществляемая благодаря образованию общих электронных пар, называется:
а) ковалентной; б) ионной; в) водородной.
2. Связь, обусловленная электростатическим притяжением
IV. Химическая термодинамика
1. Тепловой эффект реакции Fe2O3(к) + 3С(к) = 2Fe(к) + 3СО(г) можно рассчитать используя стандартные энтальпии образования по уравнению:
V. Химическая кинетика и равновесие
1. Во сколько раз следует увеличить давление, чтобы начальная скорость образования NO2 по реакции: 2NO(г) + О2(г) → 2NO2(г) возросла в 8 раз?
VI. Растворы неэлектролитов
1. Какую массу метанола (СН3ОН) должен содержать раствор с концентрацией 0,1 моль/л, если объем раствора составляет 0,5 литра:
а) 1,6 г; б) 32 г; в) 3,2 г.
2. Какую мас
VII. Растворы электролитов
1. Чему равна концентрация ионов калия в 0,1 М растворе сульфита калия, если степень диссоциации соли равна 0,75?
а) 0,15 М; б) 1,5 М; в) 0,75 М.
2. Какова концентрация ионов водо
А) Cs+ и NO3–; б) К+ и S2-; в) Ca2+ и Cl-.
4. С каким из веществ вступит в реакцию обмена в водном растворе бромид бария?
а) CuSO4; б) HNO3; в) LiOH.
5. Какие ионы могут одновременно находиться в водн
IX. Дисперсные системы и поверхностные явления
1. Дисперсными системами являются системы…
а) гетерогенные; б) гомогенные; в) однофазные.
2. Дисперсность системы характеризует…
а) меру раздробленности дисперсной фазы;
X. Окислительно-восстановительные процессы
1. Укажите, какая из предложенных частиц: проявляет свойства только окислителя.
а)
XI. Электрохимические процессы
1. Гальваническим элементом называется устройство, в котором:
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходи
XII. Коррозия
1. Укажите механизм коррозионного процесса бронзовых деталей (сплав медь-олово) в воде:
а) электрохимическая; б) химическая; в) биохимическая.
2. Какой вид коррозии стали вызывает
Перечень типовых экзаменационных вопросов
1. Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Строение и свойства молекул по типу химических связей.
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
1. Основная литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Адсорбирующиеся ингибиторы - вещества имеющие высокую адгезию к поверхности металла и создающие изоляционный слой. Ингибиторы коррозии - х
Константы диссоциации слабых кислот
Название
Формула
Константа
Азотистая
HNO2
4×10-4
Константы диссоциации слабых оснований
Название
Формула
Константа
Гидроксид
алюминия
Al(OH)3
(III) 1,38×10
Некоторых систем в водных растворах при 25 °С
Название
и символ
элемента
Электродный процесс
E°, B
Азот N
N2+4H2O+2ē=2NH2OH
Потенциалы металлов
Полуреакция
Е°, В
Полуреакция
Е°, В
Li+ + ē = Li
-3,045
Tl
Произведение растворимости веществ в воде
Вещество
Пр
Вещество
Пр
AgBr
5,3×10-13
CuI
1,1&
Некоторых веществ и ионов
Вещество
∆H°298,
кДж/моль
∆G°298,
кДж/моль
S°298,
Дж/(моль×град)
 = N или
= N или  =
=  ,
, где Р
где Р – давление насыщенного пара над чистым растворителем;
– давление насыщенного пара над чистым растворителем; , ν
, ν – количество моль растворенного вещества и растворителя.
– количество моль растворенного вещества и растворителя. Т
Т = К
= К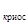 С
С = К
= К
 ,
, Т
Т = Т
= Т (растворителя) – Т
(растворителя) – Т (раствора), С
(раствора), С - моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,
- моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,  - масса растворителя, г, К
- масса растворителя, г, К - криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя.
- криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя. Т
Т = Е
= Е С
С = Е
= Е
 ,
, Т
Т = Т
= Т (раствора) – Т
(раствора) – Т (растворителя), Е
(растворителя), Е - эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя.
- эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя. = С(Х)RT,
= С(Х)RT, Т
Т = i К
= i К С
С ;
;  Т
Т = i Е
= i Е С
С ; Р
; Р = i С(Х)RT.
= i С(Х)RT. (n-1),
(n-1),  =
=
 ,
, С раствора, в 500 мл которого содержится 20 г сахара.
С раствора, в 500 мл которого содержится 20 г сахара. Н
Н О
О – неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению:
– неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению: = С(С
= С(С Н
Н О
О )RT,
)RT, H
H O
O ) =
) =  =
= = 0,117 моль/л
= 0,117 моль/л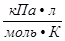 , T = 27+273 = 300 K
, T = 27+273 = 300 K = 0,117
= 0,117 ∙8,314
∙8,314 ∙300 = 291,8 кПа
∙300 = 291,8 кПа
 = 291,8 кПа
= 291,8 кПа С. Каково будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре?
С. Каково будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре? О) = 18 г/моль: n(H
О) = 18 г/моль: n(H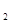 O) =
O) = =
=  = 5 моль
= 5 моль Н
Н О
О )=342 г/моль: n(C
)=342 г/моль: n(C H
H O
O ) =
) = =
= = 0,05 моль
= 0,05 моль (1 -
(1 -  ) = 23,8 (1-
) = 23,8 (1-  ) = 23,56 ( мм. рт. ст.)
) = 23,56 ( мм. рт. ст.) C выше, чем чистая вода.
C выше, чем чистая вода. Т
Т = Е
= Е С
С = Е
= Е
 . Откуда,
. Откуда, =
= 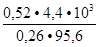 = 92 г/моль.
= 92 г/моль.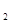 в 750 мл воды, замерзает при - 0,756
в 750 мл воды, замерзает при - 0,756 С. Вычислить кажущуюся степень диссоциации соли.
С. Вычислить кажущуюся степень диссоциации соли.
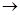 Ba
Ba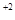 + 2Cl
+ 2Cl - cильный электролит.
- cильный электролит. Т
Т = К
= К С
С = К
= К
 ,
,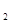 ) = 137+35,5∙2 = 208 г/моль
) = 137+35,5∙2 = 208 г/моль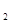 O) = V(H
O) = V(H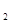 O)
O)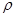 (H
(H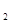 O) = 750 мл ∙1 г/мл = 750 г
O) = 750 мл ∙1 г/мл = 750 г (Н
(Н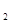 О) = 1,86 К∙кг/моль.
О) = 1,86 К∙кг/моль. Т
Т =
=  = 0,3 К , i =
= 0,3 К , i =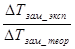 =
=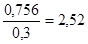 .
. (n-1) выражаем
(n-1) выражаем  ,
,  =
= .
. =0,76 или 76%
=0,76 или 76%
 1. 68,4 г сахарозы C12H22O11 растворено в 1000 г воды. Рассчитайте: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 200С равно 2314,9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52
1. 68,4 г сахарозы C12H22O11 растворено в 1000 г воды. Рассчитайте: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 200С равно 2314,9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 , соответственно.
, соответственно. , соответственно. Изотонический коэффициент хлорида натрия равен 2.
, соответственно. Изотонический коэффициент хлорида натрия равен 2. , соответственно.
, соответственно. .
. .
. .
. .
. .
.






Новости и инфо для студентов