рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
Реферат Курсовая Конспект
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры - раздел Образование, ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ Г. Владивосток Адсорбирующиеся Ин...
г. Владивосток
Адсорбирующиеся ингибиторы - вещества имеющие высокую адгезию к поверхности металла и создающие изоляционный слой. Ингибиторы коррозии - химические соединения или их композиции, присутствие которых, в небольших количествах в агрессивной среде заменяет коррозию металлов. Интеркристаллитная коррозия- коррозия по границам зёрен сплава.
Адсорбция – изменение (обычно повышение) концентрации вещества вблизи поверхности раздела фаз.
Аккумуляторы электрические - гальванические элементы, предназначенные для многократного использования
Аморфное состояние – конденсированное состояние вещества, главный признак которого – отсутствие атомной или молекулярной решетки, т.е. трехмерной периодичности структуры, характерной для кристаллического состояния.
Амфотерные гидроксиды - вещества, способные диссоциировать в водных растворах как по типу кислот, так и по типу оснований, или выступать как донорами, так и акцепторами протонов.
Аррениус Сванте Август (1859 – 1927), шведский ученый, один из основоположников физической химии.
Атом – наименьшая частица химического элемента, носитель его свойств.
Атомная единица массы – равна 1/12 массы нуклида С12. 1 а.е.м = 1,66·10-27 кг
Атомная масса – относительное значение массы атомы, выраженное в атомных единицах массы.
Больцман Людвиг (1844-1906), австрийский физик, один из основателей статистической физики, физической и физико-химической кинетики и др.
Бекетов Н.Н. (1827-1911), основатель отеч. школы физикохимиков, акад. Петерб. АН.
Валентность – способность атомов присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Ван дер Вальс Йоханнес Дидерик (1837-1923), нидерландский физик, автор уравнения состояния для реальных газов, исследователь природы межмолекулярных сил и др.
Вант Гофф Якоб Хендрик (1852 – 1911), нидерландский ученый, один из основателей физической химии, стериохимии.
Внутренняя энергия (U) системы - величина , которая характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, энергию электронных оболочек атомов , энергию атомных ядер , но без учета кинетической энергии системы как целого объекта и потенциальной энергии положения системы.
Газы – вещества в агрегатном состоянии, характеризующимся слабым взаимодействием составляющих вещество частиц, в результате чего, газы заполняют весь предоставленный им объем.
Гальванические элементы – химические источники тока, состоящие из одной ячейки, в состав которой входят два разнородных электрода и ионпроводящий электролит.
Гальванопластика - осаждение толстых, достигающих нескольких мм, легко отделяющихся от основы (формы) слоев металла, точно воспроизводящих рельеф основы.
Гальваностегия-нанесение на поверхность изделия тонких, обычно до нескольких десятков мкм, металлических покрытий.
Гельмгольц Герман Людвиг Фердинанд (1821-94), немецкий физик, биофизик, физиолог, математически обосновал закон сохранения энергии.
Гесс Герман (1802-50), химик, один из основоположников термохимии, академик Петербуржской АН.
Гиббс Джозайя Уиллард (1839-1903), американский физик теоретик, один из создателей термодинамики и статистической физики.
Гибридизация – деформация валентных электронных орбиталей разных подуровней с близкими значениями энергий, при которой возникают одинаковы по энергиям, но искаженные по геометрии электронные облака.
Гидратация – присоединение воды к молекулам, атомам или ионам.
Гидроксиды - вещества, в состав которых входят гидроксильные группы ОН. К ним относятся основания, кислоты, а так же вещества проявляющие как основные, так и кислотные свойства (амфотерные гидроксиды).
Гидрофильный золь - коллоидный раствор, частицы дисперсной фазы которого смачиваются водой.
Гидрофобный золь – коллоидный раствор, частицы дисперсной фазы которого не смачиваются водой.
Двойные соли - соли, образованные двумя металлами и одной кислотой.
Де Бройль Луи (1892-1987), французский физик, один из создателей квантовой механики.
Диаграмма состояния - функциональная зависимость какого либо параметра системы от ее состава ( для многокомпонентных систем) или графическое изображение зависимости между величинами, характеризующими состояние системы и фазовыми превращениями в ней.
Дисперсность – мера раздробленности более конденсированной фазы в гетерогенной системе.
Диссоциация - процесс распада электролита на ионы: катионы и анионы.
Диффузия – перенос частиц разной природы, обусловленный хаотическим движением молекул (атомов) в одно- или многокомпонентных газовых или конденсированных средах.
Жидкость – агрегатное состояние вещества, промежуточное между твердым и газообразным. Жидкие тела текучи, не обладают определенной формой, могут образовывать свободную поверхность и стремятся сохранить свой объем.
Зонная теория – квантовая теория строения кристаллических объектов, в основе которой лежит положение о расщеплении энергий валентных уровней при взаимодействии большого числа атомов и возникновении системы энергетических уровней близких по значениям энергии.
Изобара - функциональная зависимость какого либо параметра системы при постоянном давлении.
Изобарно-изотермический 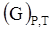 и изохорно-изотермический
и изохорно-изотермический 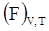 потенциалы – характеристические функции процесс, позволяющие установить направленность и предел протекания процесса в открытой и закрытой системе соответственно.
потенциалы – характеристические функции процесс, позволяющие установить направленность и предел протекания процесса в открытой и закрытой системе соответственно.
Изотерма – функциональная зависимость какого либо параметра системы при постоянной температуре.
Катализатор – вещество, изменяющее механизм протекания реакции, участвуя в процессе, само не расходуется и выделяется на последней стадии в неизменном виде.
Квантовая механика (волновая механика) – теория, устанавливающая способ описания и законы движения микрочастиц в заданных внешних полях, впервые позволила описать структуру атомов, установить природу химической связи, объяснить периодическую систему элементов.
Кинетика – раздел химии о скорости протекания и механизме протекания химических процессов.
Кислоты - вещества, способные диссоциировать в водном растворе с образованием катионов водорода (теория электролитической диссоциации) или быть донорами протонов (протонная теория).
Кислые соли - продукты частичного замещения катионов водорода.
Клечковский Всеволод Маврикиевич (1900-72), академик ВАСХНИЛ, сформулировал привила последовательного заполнения электронных оболочек атомов.
Коагуляция – процесс самопроизвольного разрушения коллоидной системы, с потерей системой сначала агрегативной, а затем и кинетической устойчивости.
Ковалентность атома – количество химических связей, которое в общем случае определяется количеством валентных орбиталей предоставляемых для образования связи.
Комплексные соединения – содержат катионный, анионный или нейтральный комплекс, состоящий из центрального атома (или иона) и связанных с ним молекул или ионов – лигандов.
Комплексные соли - см. "комплексные соединения".
Концентрация – отношение числа частиц системы (смеси, раствор, расплава), его количества или массы к объему системы.
Коррозионная гальваническая пара – анодная и катодная области на металле, возникающие под действием агрессивной электропроводной среды.
Пассивация металла - образование на его поверхности устойчивого к коррозионному разрушению слоя.
Коррозия – самопроизвольный процесс окислительного разрушения металла под действием агрессивной окружающей среды.
Кристаллическое состояние – состояние вещества, характеризующиеся наличием дальнего порядка в расположении частиц (атомов, ионов, молекул).
Ле Шателье Анри Луи (1850 – 1936), французский физикохимик и металловед.
Лиганды – нейтральные атомы, молекулы или ионы, связанные с центральным атомом комплексного соединения.
Межмолекулярное взаимодействие – взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей.
Менделеев Дмитрий Иванович (1834-1907), русский ученый-энциклопедист, фундаментальные исследования по химии, химической технологии, физике, метеорологии и др., сформулировал один из основных законов химии – периодический закон, составил периодическую систему химических элементов.
Метод валентных связей (МВС) – теория образования химической связи за счет взаимодействия электронный оболочек атомов с образованием общих электронных пар.
Мицелла – частица дисперсной фазы золя, имеющая диффузионную часть двойного электрического слоя и несущая нулевой заряд.
Молекула – микрочастица, образованная из двух или большего числа атомов и способная к самостоятельному существованию.
Молекулярная масса – сумма масс атомов, входящих в состав данной молекулы; выражается в атомных единицах массы.
Молекулярная формула - формула, отражающая качественный и колличественный состав атомов в молекуле.
Мономеры – низкомолекулярные вещества, используемые для синтеза полимеров
Оксиды - соединения, состоящие из двух элементов, одним из которых является кислород.
Олигомеры – среднемолекулярные вещества, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями.
Опалесценция – рассеяние света в результате дифракции.
Осмос – самопроизвольный перенос вещества через полунепроницаемую мембрану, разделяющую два раствора различной концентрацией или чистый растворитель и раствор.
Основания - вещества, способные диссоциировать в водном растворе с образованием гидроксид - ионов (теория электролитической диссоциации). С точки зрения протолитической (протонной) теории основания - вещества, акцепторы протонов.
Основные соли - продукты частичного замещения гидроксогрупп.
Паули Вольфганг (1900-58), швейцарский физик-теоретик, один из создателей квантовой механики.
Перенапряжение электрохимическое -разность между значениями электродных потенциалов при равновесии и при пропускании через электрод внешнего электрического тока в условиях одинакового состава приэлектродного слоя.
Питтинг - коррозия металлов ведущая к образованию полостей в металле начинающихся с его поверхности.
Плазма – частично или полностью ионизированный газ, образуемый в результате термической ионизации атомов или молекул при высоких температурах, под действием электромагнитных полей большой напряженности, при облучении газа потоками заряженных частиц высокой энергии.
Поликонденсация – реакция синтеза полимера за счет взаимодействия функциональных групп би- и полифункциональных мономеров, сопровождающаяся выделением низкомолекулярных побочных продуктов.
Полимеризация – реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера), идущая без выделения побочных продуктов.
Полимерные материалы – материалы на основе высокомолекулярных соединений; обычно многокомпонентные и многофазные.
Полимеры – высокомолекулярные вещества, макромолекулы которых состоят из повторяющихся звеньев, имеющих одинаковое строение.
Полимеры – см. полимерные материалы.
Поляризация электродная - разность между значениями электродных потенциалов при равновесии и при пропускании через электрод внешнего электрического тока.
Потенциал разложения - минимально-необходимая разность потенциалов, при которой начинается электролиз данного соединения.
Растворение – см. растворение твердых тел.
Растворение твердых тел – гетерофазное физико-химическое взаимодействие твердого тела и жидкости, сопровождающееся переходом твердой фазы в раствор.
Растворимость – способность вещества образовывать с другим веществом (или веществами) гомогенные смеси с дисперсным распределением компонентов.
Растворители – неорганические и органические вещества, а также смеси, способные растворять различные вещества.
Растворы – гомогенные смеси, состоящие из двух или более компонентов, состав которых в определенных пределах может непрерывно меняться.
Седиментация – процесс осаждения частиц дисперсной фазы золя под действием сил тяжести при потере кинетической устойчивости системы.
Селективная коррозия - результат травление стали при сохранении карбидных зерен или потеря цинка из латуней.
Смешанные соли - соли образованные одним металлом и двумя кислотами.
Соли - продукты полного или частичного замещения катионов водорода в молекуле кислоты катионами металов (или группами атомов); или продукты полного или частичного замещения гидроксильных групп в молекуле основания кислотными остатками.
Сольватация – взаимодействие молекул растворенного вещества с молекулами растворителя.
Сополимеризация – реакция образования полимеров при участии двух и более мономеров.
Средние (нормальные) соли - продукты полного замещения катионов водорода или гидоксильных групп.
Старение полимера – изменение свойств полимера во времени.
Степень полимеризации – число элементарных звеньев, повторяющихся в макромолекуле.
Структурная формула - формула, отражающая последовательность соединения атомов в молекуле, без учета пространственного строения.
Твердое тело – агрегатное состояние вещества, отличительными признаками которого при нормальных условиях являются устойчивость формы и характер теплового движения структурных единиц.
Теория молекулярных орбиталей (МО) – теория химической связи, объясняющая природу и свойства химической связи; исходящая из того, что состояние электронов в молекуле может быть описано как совокупность молекулярных электронных орбиталей со своим набором квантовых чисел.
Термодинамика химическая – раздел химии, изучающий тепловые эффекты химических реакций, возможность самопроизвольного протекания и предела протекания химических процессов, физико-химические превращения на основе представления о термодинамическом равновесии в макроскопических системах.
Термопластичные полимеры – полимеры, которые при изменении температуры способны переходить несколько раз из одного состояния (стеклообразного) в другое (вязкопластичное) без химического разрушения.
Термореактивные полимеры – полимеры, которые при нагревании разрушаются необратимо в результате химической деструкции.
Транскристаллитная коррозия – коррозия, возникающая под действием механических напряжений и приводящая к образованию трещин.
Фазовые переходы – переход вещества из одной фазы в другую при изменении параметров состояния, характеризующих термодинамическое равновесие.
Химическая связь – взаимодействие атомов, обуславливающие устойчивость молекулы или кристалла как целого.
Химические источники тока - устройства, в которых химическая энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Химический эквивалент – условная частица в целое число раз меньшая (или равная) соответствующей ей формульной единицы – атома, молекулы, иона, радикала и др.
Электродные процессы – процессы, характеризующиеся переносом зарядов через границу между электродом и электролитом. Всегда идут в двух направлениях – катодном и анодном.
Электродные процессы – процессы, характеризующиеся переносом зарядов через границу между электродом и электролитом. Всегда идут в двух направлениях – катодном и анодном.
Электродный потенциал – разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Обусловлен образованием у поверхности электрода двойного электрического слоя.
Электроды в электрохимии - электронно - проводящие фазы ( металлы или полупроводники), контактирующие с ионным проводником (электролитом).
Электролиз – химические реакции, протекающие под действием постоянного электрического тока на электродах, помещённых в электролит.
Электролиз – химические реакции, протекающие под действием постоянного электрического тока на электродах, помещённых в электролит.
Электролиты - жидкие и твёрдые вещества, обладающие преимущественно ионной проводимостью.
Электроосмос – перемещение дисперсионной среды при фиксированном положении дисперсной фазы под действием внешнего электрического поля.
Электрофорез – процесс перемещения заряженных частиц золя при наложении внешнего электрического поля на коллоид.
Электрохимия – раздел, изучающий физико – химические свойства растворов, расплавов или твёрдых электролитов, а также явления, возникающие на границе двух фаз с участием заряженных частиц электронов и ионов.
Энергия – общая количественная мера различных форм движения материи.
Энтальпия (Н) – термодинамическая функция состояния системы, рассматриваемая как энергия системы, над которой произведена работа по изменению ее объема.
Энтропия (S) - термодинамическая функция состояния системы и функция термодинамической вероятности системы, являясь мерой порядка в системе.

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Дальневосточный федеральный университет»
(ДВФУ)

– Конец работы –
Эта тема принадлежит разделу:
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ... Федеральное государственное автономное образовательное учреждение...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов