рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Способы выражения концентрации растворов
Реферат Курсовая Конспект
Способы выражения концентрации растворов
Способы выражения концентрации растворов - раздел Образование, В качестве учебного пособия Для Количественной Характеристики Растворов Используют Понятие Концентрации:...
Для количественной характеристики растворов используют понятие концентрации:
Концентрация – величина, выражающая относительное содержание данного компонента в системе (смеси, растворе).
Из концентраций растворов наибольшее применение в химии находят следующие:
Процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах массы раствора, и для его приготовления следует взять 12 единиц массы СаСl2 и 88 единиц массы растворителя.
Молярная концентрация раствора (молярность) – отношение количества этого вещества, содержащегося в растворе (в молях), к объему раствора:
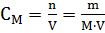 ,
,
где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л. Единица Си – моль∙м-3, обычно применяют моль∙л-1.
Молярным называется раствор, в 1л которого содержится 1 моль растворенного вещества.
Эквивалентная (нормальная) концентрация раствора (нормальность) – отношение числа эквивалентов вещества, содержащегося в растворе, к объему раствора:
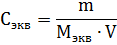
где m – масса растворенного вещества; Мэкв – молярная масса эквивалента растворенного вещества.
Единица эквивалентной концентрации в СИ – моль∙м-3, обычно применяют моль∙л-1.
Молярная концентрация раствора (моляльность) определяется числом молей растворенного вещества в 1кг (1000г) растворителя. Единица моляльности раствора в СИ – моль∙кг-1, можно применять моль∙г-1.
Основная особенность моляльного способа выражения концентрации заключается в том, что моляльная концентрация раствора не зависит от температуры, поскольку для определения моляльности не привлекается объем.
Массовой долей растворенного вещества называют отношение массы растворенного вещества к общей массе раствора. Массовую долю обычно выражают в долях единицы и обозначают W.
Мольная доля – отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор.
Для приготовления растворов заданных концентраций должны проводиться соответствующие расчеты.
Пример 1. Какой массы кристаллогидрат ВаCl2∙2H2O надо взять для приготовления раствора объемом 0,5л, в котором массовая доля ВаСl2 составляет 0,1 (10%-ный раствор)?
Решение. Если W(BaCl2) =0,1 или 10%, то плотность раствора р=1,090г∙см-3 (из справочных таблиц). Тогда масса раствора BaCl2 заданного объема равна 500∙1,090=545,0 (г). Масса BaCl2 в этом растворе находится из пропорции:
m(BaCl2) – m(р-ра BaCl2)
10 г – 100 г
х г – 545 г
х = 54,5г
Масса кристаллогидрата:
m(BaCl2∙2H2O) – m(BaCl2)
244,2г – 208,4г
х г – 54,5г
х = 64,0 г
Пример 2. Какова масса KCl, содержащегося в 0,5л раствора, если молярная концентрация раствора 0,2 моль∙л-1?
Решение. Молярную концентрацию (моль∙л-1) выражают формулой:
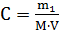 , где m1 – масса растворенного вещества, г; M – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л.
, где m1 – масса растворенного вещества, г; M – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л.
M(KCl) = 74,5г∙моль-1. Масса KCl, содержащегося в растворе, равна m1=M∙V∙C=0,2∙0,5∙74,5=7,45г.
Пример 3. Определите эквивалентную концентрацию хлорида железа (3), если в 0,3л раствора содержится 32,44г PeCl3.
Решение. Эквивалентная концентрация (нормальность раствора) рассчитывается по формуле:
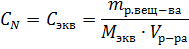
Молярная масса эквивалента PeCl3 равна:
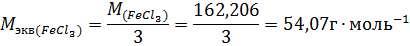
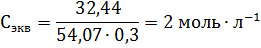
Пример 4. В какой массе воды надо растворить 5,85г хлорида натрия, чтобы получить раствор, моляльность которого равна 0,3моль∙г-1.
Решение. Моляльность раствора рассчитывается по формуле:
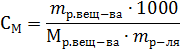
где mр-ля – масса растворителя в г. Отсюда:
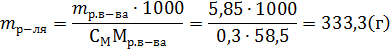
Пример 5.Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие.
Вычислите эквивалентную концентрацию, молярную концентрацию и моляльность раствора, в котором массовая доля СиSO4 равна 0,10. Плотность раствора 1107кг∙м-3.
Решение. Определим молярную массу и молярную массу эквивалента СиSO4.
M(СиSO4) = 160г∙моль-1; Мэкв(СиSO4) = 160/2=80г∙моль-1.
В 100 г раствора с ω(СиSO4)=0,1 содержится 10,0г СиSO4 и 90 г H2O. Следовательно, СМ раствора СиSO4 равна:
 .
.
СМ и Сэкв относятся к 1 литру раствора: m=p∙V=1107∙10-3=1,107кг. В этой массе раствора содержится 1,107∙0,1=0,1107кг СиSO4, что составляет 110,7/159,61=0,693 моль или 0,693∙2=1,386экв.
Молярная концентрация и эквивалентная концентрация данного раствора соответственно равны 0,693 и 1,386моль∙л-1.
Пример 6. Расчеты, связанные с приготовлением разбавленных растворов из концентрированных.
Какой объем раствора азотной кислоты массовой долей HNO3 0,3(p=1180кг∙м-3) требуется для приготовления 20л 0,5 М раствора этой кислоты?
Решение. Сначала определяем массу азотной кислоты в 20л 0,5 М раствора:
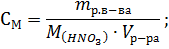
М(HNO3) = 63г∙моль-1; mр.в-ва = 0,5∙63∙20=630г.
Так как 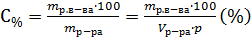 ; Следовательно для приготовления 20л 0,5 М раствора HNO3, надо израсходовать всего 1,78л раствора азотной кислоты 30%-й концентрации.
; Следовательно для приготовления 20л 0,5 М раствора HNO3, надо израсходовать всего 1,78л раствора азотной кислоты 30%-й концентрации.
Пример 7. Вычислите :а) массовую(процентную) (с,%); б) молярную концентрацию (см); молярную концентрацию эквивалента (сн); г) молярную (см) концентрацию раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031г/см3. Чему равен титр Т этого раствора?
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды модно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно:
300 – 18
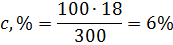
100 – с,%
б) молярная (мольно-объемная)% концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения
300 – 18
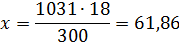
1031 – х
Молярную концентрацию раствора получим делением числа граммов Н3РО4 в 1 л раствора на молярную массу Н3РО4 (97,99 г/моль):
см = 61,86/97,99 = 0,63 М.
в) молярная концентрация эквивалента (или нормальность)
показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Н3РО4 = М/ 3 = 97,99/3 = 32,66 г/моль, то
Cн = 61,86/32,66= 1,89 н.;
г) моляльная концентрация (или моляльность) показывает
число молей растворенного вещества, содержащихся в 1000 г
растворителя. Массу Н3РО4 в 1000 г растворителя находим из
соотношения
282 – 18
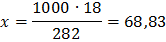
1000 – х
Отсюда см = 63,83/97,99 = 0,65 м.
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т=61,86/1000 = 0,06186 г/см3
Зная молярную концентрацию эквивалента и молярную массу эквивалента (тэ) растворенного вещества, титр легко найти по формуле
Т=снmэ/1000.
Пример 8.На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3' 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их норма-льностям, т.е.
V1:V2 =CH2 : СН1 или V1∙СН1 =V2∙CH2
50 СН1 = 25 ∙ 0,5 откуда CH1 = 25 ∙0,5 / 50 = 0,25н
Пример 9.К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН равна 1092 г. В этом растворе содержится 1092 ∙10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 ∙ 0,5 = 522,5 г. В этом растворе содержится 522,5 ∙ 5/100 = 26,125г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярная концентрация раствора Cм=135,325/(2 ∙ 56,1) = 1,2 М, где 56,1 г/моль — молярная масса КОН.
Пример 10.Какой объем 96%-ной серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалентная масса H2SO4 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04∙0,4∙3= = 58,848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 ∙ 96/100 = 1,766 г H2SO4.
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848 : 1,766 = 33,32 см3 этой кислоты.
– Конец работы –
Эта тема принадлежит разделу:
В качестве учебного пособия
Вологодский государственный технический университет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Способы выражения концентрации растворов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов