рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- В качестве учебного пособия
Реферат Курсовая Конспект
В качестве учебного пособия
В качестве учебного пособия - раздел Образование, Министерство Образования И Науки Российской Федерации Вологодский Го...
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Вологодский государственный технический университет
Г.А. Тихановская, Л.М. Воропай, В.В. Кочетова
ХИМИЯ
Утверждено редакционно - издательским советом ВоГТУ
в качестве учебного пособия
Вологда
УДК
ББК
Т
Рецензенты:
Т.Л. Бланк, канд. хим. наук, доцент Вологодской
молочнохозяйственной академии им. Н.В. Верещагина;
М. А. Тихонов, консультант ООО «Александра-Плюс»
Тихановская, Г.А.
Учебное пособие по курсу «Химия» предназначено для студентов всех технических направлений бакалавриата, включает…ПРЕДИСЛОВИЕ
Учебное пособие по химии подготовлено коллективом авторов в связи с переходом высшей школы на двухступенчатую систему образования. Из-за уменьшения объема часов, отведенных под аудиторные занятия, особое значение приобретает сокращение объема материала без потери сведений, касающихся основных законов и положений химии. Эта цель достигается за счет изложения материала в сжатой реферативной форме.
Особая роль отведена рассмотрению способов решения типовых задач по основным разделам курса. Это поможет студентам при изучении тем, вынесенных на самостоятельную проработку. Пособие ориентировано на достаточное глубокое изучение курса при минимальных затратах времени, включает 10 глав по общим темам и специальный раздел по металлам и сплавам. Может быть также использовано студентами заочной формы обучения при самостоятельной подготовке и выполнении контрольных работ.
ВВЕДЕНИЕ
Химия – наука о веществах и законах, которым подчиняются их превращения, одна из отраслей естествознания. Она относится к числу фундаментальных наук о природе и является областью практической деятельности.
В данном пособии рассматриваются главным образом группы вопросов, лежащих в основе многих химических технологий:
- свойства и строение различных веществ (а также частиц, из которых они состоят – молекул, атомов и ионов) в зависимости от их химического состава и химического строения и от условий существования;
- изучение химических реакций и других форм взаимодействия между веществами и частицами (направление, скорость, молекулярный механизм и термодинамические параметры процесса) в зависимости от их химического состава и строения и от условий, в которых происходит процесс, а также от внешних воздействий – электрических, ионизирующих, световых и т.д.
Содержание курса разделено на несколько основных разделов, характеризующих направление химической науки и определяющих ее предмет.
Атомно-молекулярное учение включает закон Авогадро, эквивалент, закон эквивалентов, определение молекулярных масс, важнейшие классы неорганических соединений, газовые законы и химические расчеты.
Химическая термодинамика рассматривает основные соотношения, вытекающие из первого закона термодинамики, которые позволяют рассчитать количество выделяемой или поглощаемой теплоты и определить, как будет влиять на него изменение внешних условий. На основе второго закона термодинамики определяется возможность самопроизвольного течения процесса, а также условия и положение равновесия и его смещения под влиянием изменения внешних условий.
Химическая кинетика изучает скорость и молекулярный механизм химической реакции как в гомогенной, так и гетерогенной среде.
Учение о растворах рассматривает природу растворов, их внутреннюю структуру и важнейшие свойства, зависимость свойств растворов от концентрации и химической природы компонентов и вопросы растворимости.
Электрохимия изучает некоторые особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза, водность растворов, процессы электролиза, работу гальванических элементов и электрохимическую коррозию металлов.
Такое деление всегда условно, т.к. реальный процесс обычно связан с несколькими явлениями. Любое явление в природе может быть понятно и обосновано, если оно рассматривается в его неразрывной связи с окружающими явлениями.
Знание химии дает специалисту ключ к пониманию механизма химических процессов и, следовательно, к сознательному регулированию их, к выбору условий, наиболее благоприятных для проведения производственных процессов.
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ В ХИМИИ
Основные химические понятия
Атом– наименьшая частица элемента, обладающая его химическими свойствами и неделимая при химических реакциях. Молекула – наименьшая частица вещества, обладающая его химическими… Простое вещество – вещество, в состав которого входят атомы одного и того же элемента.Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
где mA, mВ – массы взаимодействующих веществ А и В; ЭА и ЭВ – эквиваленты этих веществ.Законы газового состояния. Определение молярных масс газообразных веществ
Закон Бойля – Мариотта. При постоянной температуре объем данной массы газа изменяется обратно пропорционально давлению: или V1 P1= V2 P2=V3P3…, т.е. V∙P=const.СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА
Теория Бора привела в согласие модель атома с его спектрами, объяснив их происхождение и структуру [1].Этапы на пути создания квантовой механики
Математическая запись этого принципа называется соотношением неопределенности: ∆ рх ∆ х >h , где ∆ рх и ∆ х –… Это приводит к тому, что траекторию электрона заменяет только вероятность… Гипотеза Луи де Бройля о том, что микрочастицы, подобно свету имеют двойственную природу (частица-волна) , выражена…Элементы квантово-механической теории атома
Четвертое квантовое число, которое называют спиновым, характеризует собственное движение электрона. Значения четырех квантовых чисел полностью…Характеристика квантовых чисел
С увеличением значений n и ℓ энергия электрона возрастает. Состояния электрона с одинаковым значением энергии называют вырожденными, а число… Волновая функция при определенных значениях трех квантовых чисел(n,ℓ и… Каждой АО соответствует область пространства определенного размера, формы и ориентации, равноценная понятию…Некоторые свойства свободных и связанных атомов
Энергия ионизации, необходимая для отрыва электрона от свободного невозбужденного атома, обычно выражается в электронвольтах (эВ), а соответствующий… Резкое увеличение ионизационного потенциала с уменьшением для электрона… Сродство к электрону количественно оценивается энергетическим эффектом, сопровождающим присоединение электрона к…ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Каждый атом представляет собой систему из положительно заряженного ядра и отрицательно заряженных электронов, поэтому связь между атомами является результатом электростатического взаимодействия этих систем. Характер такого взаимодействия раскрывается в описании типов химической связи.
Ковалентная связь. Метод валентных связей
Принципиально возможны два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их… Причиной образования любого типа химической связи является понижение энергии… Расстояние между ядрами двух атомов, при котором силы притяжения уравновешиваются силами отталкивания и система имеет…Ионная связь
Чем больше разность электроотрицательностей ΔЭО для данной пары атомов, тем больше длина диполя и величина эффективных зарядов, а… Полного, т.е. 100%-ного, смещения электронной плотности на атом с большей ЭО… Отрицательное сродство атомов ко второму электрону делает невозможным существование простых многозарядных ионов (О2- ,…Металлическая связь
Из первого характерного свойства металлов следует, что по крайней мере часть электронов может передвигаться по всему объема куска металла. С другой… Для образования двухэлектронных связей в подобной структуре атом лития должен… Таким образом, в отличие от ковалентных и ионных соединений, в металлах небольшое число электронов одновременно…Водородная связь
А----------------------------- δ+Н………………………………………… δ-В ковалентная водородная связьОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ И ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Энергетика химических превращений
Энергетические эффекты реакций изучает термохимия. Данные об энергетических эффектах реакций используются для расчетов тепловых балансов… Химические реакции обычно протекают при постоянном давлении (например, в… Состояние системы описывается с помощью ряда переменных: давления, объёма, температуры, массы, энергии. На основе этих…Энтропия
Частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного… где R- газовая постоянная.Химическая кинетика
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а… Если в результате реакции выделяется теплота, то ∆Н < 0. Считывая… РС15(к) + Н2О(г) = РОСl 3(ж) + 2НС1(г); ∆Нхр = -111,4 кДжСкорость химической реакции
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе).… Скоростью реакции называется число элементарных актов реакции, происходящих в… О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски,…Катализ
Изменение скорости катализируемой реакции за счет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим,… А + В → А...В → АВ Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть…Химическое равновесие
Константа химического равновесия
Если H2 и I2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции… Так как при химическом равновесии скорости прямой и обратной реакций равны V1…Принцип Ле Шателье
Смещение равновесия в зависимости от изменения условий в общем виде определяется принципом Ле-Шателье (или принципом подвижного равновесия): если на… Так, повышение температуры вызывает смещение равновесия в направлении того из… Если в систему, находящуюся в состоянии равновесия, добавить некоторое количество какого-либо из веществ, участвующих…ДИСПЕРСНЫЕ СИСТЕМЫ
Различают несколько видов дисперсных систем в зависимости от степени дисперсности, т.е. величины, обратной среднему радиусу частиц дисперсной фазы:… Микрогетерогенные системы с размером частиц 1…100нм представляют собой…Способы выражения концентрации растворов
Концентрация – величина, выражающая относительное содержание данного компонента в системе (смеси, растворе). Из концентраций растворов наибольшее применение в химии находят следующие: Процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах…Свойства разбавленных растворов
Мерой интенсивности протекания осмоса является осмотическое давление, которое согласно закону Вант-Гоффа (1887г.) зависит от молярной концентрации… Росм=СМ∙R∙T, где R – газовая постоянная, равная 8,31Дж/моль∙К; СМ – молярность.Давление пара растворителя над раствором (первый закон Рауля).
, где Р0-давление пара чистого растворителя; Р1- давление пара растворителя над…Температуры кипения и замерзания растворов (второй закон Рауля).
Согласно 2-му закону Рауля изменение температур кипения и замерзания растворов пропорционально моляльности растворов: ∆tкип=Кэ∙Сm; ∆tзам=Кк∙Сm, где Кэ –эблуоскопическая («абулио» - кипеть), а Кк – криоскопическая («криос» - холод) константы растворителя.…Осмотическое давление разбавленных растворов неэлектролитов
Росм=СМRT, где R – универсальная газовая постоянная, значение которой определяется… Поскольку СМ=n/V, то уравнение Вант-Гоффа аналогично уравнению Менделеева-Клапейрона, которое характеризует газовое…Давление пара разбавленных растворов неэлектролитов. Первый закон Рауля.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества, т.е. , где N и… Пример 1. Вычисление давления пара растворителя над раствором. Определите… Решение. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается…Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля
∆toзам=КК∙С; ∆toкип=КЭ∙С; где ∆toзам – понижение температуры замерзания раствора; ∆toкип –… Если «m» граммов неэлектролита, имеющего молярную массу М, растворены в m граммах растворителя, то закон Рауля для…Растворы электролитов
Количественной характеристикой электролитической диссоциации является степень диссоциации α. α.= Сдисс/Собщ–отношение концентрации молекул, распавшихся на ионы, к… По величине α электролиты можно условно разделить на сильные, средние и слабые. Для сильных электролитов…Степень диссоциации различных электролитов
Концентрация ионов в растворе электролита зависит от молярной концентрации См,… Сионов=См∙αni. Например, для раствора Н2SO4 0,5 моль/л при α=50% концентрация ионов водорода…Ионное произведение воды. Водородный показатель
Подставляя в уравнение Кдисс [Н2O]=[Н+]∙[0Н-] концентрацию воды, которая… где КН2О=1∙10-14 - ионное произведение воды; КН2О зависит от температуры, с повышением температуры КН2О…Равновесие в гетерогенных системах, произведение растворимости
твердая насыщенный фаза раствор В единицу времени в насыщенный раствор переходит столько ионов, сколько их вновь переходит в осадок. Это состояние…Физико-химические свойства растворов электролитов.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита. Вычислить степень диссоциации 0,2 М раствора муравьиной кислоты HCOOH, если… Решение: По закону разбавления α=√(Кд/См) = √(2,1∙10-4/0,2)=3,24∙10-2 или 3,24%.Ионное произведение воды. Водородный показатель
Константа диссоциации воды весьма мала при 25°С Принимая поэтому концентрацию воды [Н2О] величиной практически постоянной, можно записать К∙ [Н2О]=[Н+] ∙…ГИДРОЛИЗ СОЛЕЙ
1. Гидролиз по катиону. Характерен для солей, образованных слабым основанием и сильной кислотой (например, NН4Сl, Al(NO2)3, CuSO4 и др.). Рассмотрим… Молекулярное уравнение гидролиза записывается в виде NН4Сl+Н2ОNН4ОН+НСl.Примеры сильных и слабых кислот и оснований
| Кислоты | Основания | |||
| Сильные | Средней силы | Слабые | Сильные | Слабые |
| HCL | H3PO4 | HCN | Гидроксиды щелочных металлов (KOH, NaOH, ZiOH), Ba(OH)2 и др. | Na4OH и нерастворимые в воде основания (Ca(OH)2, Zi(OH)2, AL(OH)3 и др. |
| HBr | H2SO3 | HNO2 | ||
| HI | HP | H2CO3 | ||
| HNO3 | H2S | |||
| H2SO4 | CH3COOH | |||
| HMnO4 | HCIO | |||
| HCLO4 |
Константа гидролиза равна отношению произведения концентраций
продуктов гидролиза к концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза NH4Cl.
Решение: Из таблицы находим Кд(NH4ОН)=1,8∙10-3, отсюда
Кγ=Кв/Кдк= =10-14/1,8∙10-3= 5,56∙10-10.
Пример 2. Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn2 + H2O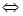 ZnOH+ + H+
ZnOH+ + H+
KдZnOH+1=1,5∙10-9; hγ=√(Кв/ [Кдосн∙Cм]) = 10-14/1,5∙10-9∙0,5=0,36∙10-2 (0,36%).
Пример 3.Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN- + Н2О 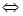 HCN + ОН-
HCN + ОН-
или в молекулярной форме
KCN + Н2О 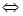 HCN + КОН
HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО-3 , а не молекулы Н2СО3, так как ионы НСО-3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO2-3 +H2O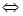 HCO-3 +ОН-
HCO-3 +ОН-
или в молекулярной форме
Na2CO3 + Н2О 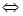 NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOН+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + Н2О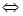 ZnOН+ + Н+
ZnOН+ + Н+
или в молекулярной форме
2ZnSO4 + 2Н2О 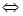 (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 4.Какие продукты образуются при смешивании растворов A1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О 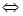 А1ОН2+ + Н+
А1ОН2+ + Н+
СО2-3 + Н2О 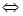 НСО- з + ОН-
НСО- з + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + ЗСО2-3 + ЗН2О = 2А1(ОН)3 + ЗСО2
молекулярное уравнение: ЗСО2 + 6KNO3
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3
Произведение растворимости. Примеры решения задач
Гетерогенное равновесие "осадок ↔ насыщенный раствор" подчиняется правилу произведения растворимости, если малорастворимый
электролит диссоциирует по уравнению AmBn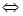 [А+]m - [B-]n. Отсюда вытекают два следствия:
[А+]m - [B-]n. Отсюда вытекают два следствия:
1. Условие растворения осадка. Произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости:[А+]m[B-]n<ПР (AmBn).
2. Условие осаждения осадка. Произведение концентраций ионов,
возведенных в степень их стехиометрических коэффициентов, должно
быть больше величины произведения растворимости: [А+]m[B-]n>Пр(AmBn).
Пример 1. Определение условий выпадения осадка. Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов хлористого кальция и углекислого натрия? (Пр(СаСО3) = 1,0∙10-3)
Решение: При смешении равных объемов растворов CaCI2 и Na2CO3 объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно,
[CaCI2]= [Ca+2] = 0,02∙0,5=1∙10-2 моль∙л-1.
[Na2CO3] = [CО32-] = 0,2∙0,5 = 1∙10-2 моль∙л-1.
Откуда [Ca+2]∙[CО32-]= 1∙10-2 ∙1∙10-2 = 1∙10-4 . Осадок образуется, так как 1,0∙10-3< 1∙10-4.
Пример 2. Вычисление концентрации ионов малорастворимого электролита в его насыщенном растворе.
Произведение растворимости BaF2 при 18ºС равно 1,7∙106. Рассчитайте концентрацию ионов Ba+2 и F- в насыщенном растворе BaF2 при этой температуре.
Решение: BaF2 диссоциирует по уравнению BaF2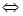 Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
ПР (BaF2) = [Ва+2] ∙ 2∙ [Ва+2]2 = 4[Ва+2]3= 1,7∙10-6
Концентрация ионов [Ва+2] равна: [Ва+2]= √1,7∙10-6 / 4 = 0,75∙10-2 моль∙л-1;
Концентрация ионов F-1 равна: [F-1]=0,75∙10-2∙2=1,5∙10-2 моль∙л-1;
Пример 3. Вычисление произведения растворимости малорастворимого электролита.
Растворимость Ag3PO4 в воде при 20ºС равна 0,0065 г∙л-1. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 в моль∙л-1 равна:
Р=6,5∙10-3/418,58 = 1,6∙10-5 моль∙л-1.
При диссоциации 1 моль Ag3PO4 образует 3 моль ионов Ag+. 1 моль ионов PO43-, поэтому концентрация ионов PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
С[PO43-] =1,6∙10-5моль∙л-1. [Ag+]= 3∙1,6∙10-5.
Произведение растворимости Ag3PO4 равно:
ПР=[Ag+]3 + [PO43-]= (4,8∙10-5)3∙1,6∙10-5= 110,6 ∙10-15∙1,6∙10-3= 1,77∙10-18.
Пример 4. Определение условий одновременного выпадения осадков солей из раствора.
При каком соотношении концентрации ионов Zn+2Cd+2 в растворе прибавление к нему раствора Na2CO3 вызывает одновременное осаждение карбонатов этих ионов? ПР(ZnCOз)= 6∙10-11
Решение. Концентрацию вводимых карбонат-ионов обозначим через
[СО32- ], тогда
[Zn+2]=ПР(ZnCOз) / С(СО32-), [Cd+2] = ПР (CdСОз)/[СО32- ].
[Zn+2]/[Cd+2] = ПР(ZnCOз)/ПР (CdСОз)=6∙10-11/2,5∙10-14=2,4∙103=2400
Карбонаты цинка и кадмия будут выпадать одновременно из раствора, если [Zn+2] >[Cd+2] в 2400 раз. Если отношение [Zn+2] /[Cd+2] > 2400, то первым из раствора будет выпадать ZnCO3, до тех пор, пока отношение [Zn+2] /[Cd+2] не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [Zn+2] /[Cd+2] не достигнет значения, при котором ZnCOз и CdСОз будут осаждаться одновременно.
Пример 5. Вычисление растворимости электролита по величине
произведения растворимости.
Произведение растворимости ПР оксалата бария ВаС2О4 равно
1,62∙10-1. Вычислите растворимость ВаС2О4 в воде.
Решение. В растворе труднорастворимого сильного электролита
ВаС2О4 существует равновесие: ВаС2О4= Ва+2 + (С2О42-).
ПрВаС2О4= [Ва+2] ∙ [С2О42-]
в осадке в растворе
Так как оксалат бария диссоциирует на два иона, то его концентрация в растворе равна концентрации каждого из ионов, т.е.
[ВаС2О4] = [Ва+2] = [С2О42-] = √1,62∙10-7 = 0,4∙10-3моль-л-1,
т.е. растворимость оксалата бария в воде при t =20°С равна 0,4∙10-3моль-л-1.
ЖЕСТКОСТЬ ВОДЫ
Карбонатная жесткость обусловлена содержанием гидрокарбонатов кальция и магния; некарбонатная – содержанием сульфатов или хлоридов кальция и… Вода, обладающая карбонатной жесткостью, при кипячении дает осадок, состоящий… Са(НСС3)2 → СаСО3↓ + СО2↑ + Н2ООКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Окисление-восстановление — это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление —… Повышение или понижение степени окисления атомов отражается в электронных… Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет…Электродные потенциалы и электродвижущие силы
Ме + m Н2О Ме(Н2О) n+m + ne- в растворе на металле где n - число электронов, принимающих участие в процессе.Электролиз
Решение. Согласно законам Фарадея m = ЭIt/96500, (1) где т — масса вещества, окисленного или восстановленного на электроде; Э — молярная масса эквивалента вещества; I —…КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ
Основные понятия
Кристаллическое состояние веществ — одно из самых распространенных в окружающей нас природе. Кристаллическими являются очень многие синтетические материалы, используемые в современной технике: полупроводники, ферромагнетики, сверхпрочные и жаростойкие сплавы. В связи с этим изучение кристаллического состояния является делом первостепенной научной важности.
Каковы основные признаки кристаллического состояния? Твердое вещество существует в двух формах: оно может быть кристаллическим или аморфным. Одно из характерных свойств кристаллического вещества, в отличие от аморфного, — это способность самоограняться. Кристаллы образуются по-разному: они выпадают в осадок при упаривании раствора, возникают при охлаждении расплава, при достаточно низкой температуре, они растут из паров (иней или морозные узоры на стекле). И во всех этих случаях на поверхности кристаллов самопроизвольно возникают плоские грани.
Вместе с тем, огранка — хотя и характерный, но не обязательный признак кристаллического вещества. В некоторых случаях грани кристаллов бывают выражены весьма нечетко. Иногда вещество состоит из таких мелких кристалликов, что грани трудно обнаружить даже под микроскопом. Кроме того, если кристалл обточить, придав ему округлую форму, лишенную граней, вещество не перестанет быть кристаллическим и свойства его останутся прежними.
Способность самоограняться — это лишь одно из проявлений более общего, наиболее важного качества кристаллов — их анизотропии (различие свойств по разным направлениям).
Если из кристалла поваренной соли, имеющего форму куба, выточить шар, а затем погрузить его в насыщенный раствор соли и медленно упаривать раствор, то кристалл начнет расти и постепенно снова примет форму куба. Этот опыт показывает, что скорость роста кристалла в разных направлениях неодинакова. Грани кристалла возникают перпендикулярно направлениям, по которым скорость роста минимальна.
Анизотропия проявляется в очень многих физических свойствах кристаллов. В отличие от кристаллических, аморфные вещества, имеющие совершенно одинаковые свойства по всем направлениям, называют изотропными. В этом отношении они подобны жидкостям и газам.
Еще одна характерная особенность кристаллов — фиксированная температура плавления. При нагревании кристаллическое вещество до определенной температуры остается твердым, а затем начинает плавиться, переходя в жидкое состояние. Пока продолжается плавление, температура не повышается. Аморфные вещества ведут себя иначе. При нагревании куска стекла он начинает постепенно размягчаться и, наконец, растекается, принимая форму сосуда. Невозможно установить, при какой температуре это произошло. Вязкость стекла уменьшается постепенно, никакой остановки в росте температуры нет.
Но самая важная особенность кристаллического вещества заключается в упорядоченном расположении его атомов.
На рисунке 2 показано внутреннее строение кристалла (а) и аморфного вещества (б) того же состава.
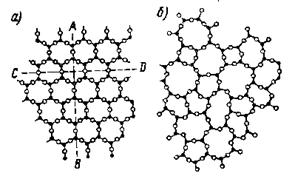
Рис 2. Внутренне строение кристаллического вещества
Рисунок имеет условный характер, так как в действительности атомы вещества располагаются не на плоскости, а в пространстве. Рассмотрим атомы, обозначенные черными точками. В обоих случаях окружение каждого из таких атомов почти одинаково: ближайшие соседи располагаются по вершинам треугольника, совершенно правильного при кристаллическом и почти правильного при аморфном состоянии. Значит, и в аморфном веществе имеется так называемый «ближний порядок». Но если принять во внимание не только самых близких соседей, то выяснится, что в кристалле окружение каждого атома остается одинаковым, а в аморфном веществе оно окажется разным. Поэтому говорят, что в кристаллическом теле, в отличие от аморфного, наблюдается «дальний» порядок. Следствием этого являются все особые свойства кристаллов. Естественно, что в направлении АВ, параллельном направлению некоторых связей между атомами, свойства будут не такими, как в направлении CD, вдоль которого такие связи не проходят. В аморфном веществе подобных специфических направлений мы не найдем. Так объясняется анизотропия кристаллов, в частности различная скорость роста в различных направлениях, а следовательно, и способность самоограняться.
В приведенном примере мы рассматривали вещество, которое может существовать и в аморфном и в кристаллическом состоянии. Это действительно так. При быстром охлаждении расплавленного сахара получается аморфная масса (леденец), при медленном охлаждении в образующемся твердом сахаре можно заметить поблескивающие кристаллики.
Нетрудно понять, почему так происходит. Представим себе роту солдат, которым приказано строиться. Если им дать для этого хотя бы немного времени, они успеют занять свои места, выровнять ряды. Если же после команды «строиться» будет сразу подана команда «стой», то расположение солдат так и останется беспорядочным, хотя, может быть, и наметится какая-то тенденция к порядку. Нечто подобное происходит и при затвердевании: если процесс идет медленно, частицы успевают занять отведенные им места, быстрое затвердевание не дает им такой возможности.
Но даже в твердом аморфном веществе, хотя и очень медленно, атомы перемещаются и постепенно упорядочивают свое расположение. Леденец, пролежав несколько месяцев, начинает кристаллизоваться «засахариваться». Старинное стекло иногда мутнеет — в нем образуется множество мельчайших кристалликов и возникающая неоднородность материала приводит к потере прозрачности.
Аморфное вещество самопроизвольно переходит в кристаллическое, а вот противоположный процесс никогда не наблюдается. Отсюда следует очень важный вывод: кристаллическое состояние — это равновесное, наиболее устойчивое состояние твердого вещества.
Симметрия кристаллов. Система кристаллов
Рис. 3 Виды симметрии кристалла Точно так же он может быть повернут на 240° (на две трети оборота), и снова невозможно будет отличить его новое…Кристаллические решетки
Распределяя согласно элементам симметрии точки в пространстве, они получили 230 комбинаций, 230 кристаллических решеток, которые соответствуют всем… Последующее исследование кристаллов с помощью лучей Рентгена немецким ученым…СПЛАВЫ
Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме того, металлические материалы очень многочисленны и разнообразны по своим свойствам.


Рис. 13 Рис. 14
В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие:
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов, отчетливо выявляемых на микрошлифе (рис. 13).
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 14). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
Диаграммы состояния металлических систем
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и перегибам на них, вызванным тепловыми… На рис. 15 слева показано, какой вид имеет кривая охлаждения чистого…БИБЛИОГРАФИЧЕСКИЙ СПИСОК
2. Глинка, Н. Л. Задачи и упражнения по общей химии : учеб. пособие для нехим. специальностей вузов / Н. Л. Глинка, под ред. В. А. Рабиновича, Х. М.… 3. Введение в химию окружающей среды: пер. с англ./ Дж.Андруз, П. Бримблекумб,… 4. Артеменко, А.И. Органическая химия: учебник для строит. специальностей вузов / А.И. Артеменко. – Изд. 5 –е, испр..…Термодинамические константы некоторых веществ
ОГЛАВЛЕНИЕ
| ПРЕДИСЛОВИЕ | |
| ВВЕДЕНИЕ | |
| 1.ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ В ХИМИИ | |
| 1.1. Основные химические понятия | |
| 1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента | |
| 1.3 Законы газового состояния. Определение молярных масс газообразных веществ | |
| 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА | |
| 2.1. Этапы на пути создания квантовой механики | |
| 2.2. Элементы квантово-механической теории атома | |
| 2.3. Некоторые свойства свободных и связанных атомов | |
| 3. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ | |
| 3.1. Ковалентная связь. Метод валентных связей | |
| 3.2. Ионная связь | |
| 3.3. Металлическая связь | |
| 3.4. Водородная связь | |
| 3.5. Молекулярное взаимодействие | |
| 4. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ И ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ | |
| 4.1. Энергетика химических превращений | |
| 4.1.1. Термохимия. Закон Гесса | |
| 4.1.2. Энтропия | |
| 4.1.3. Энергия Гиббса и направленность химических процессов | |
| 4.2. Химическая кинетика | |
| 4.2.1. Скорость химической реакции | |
| 4.2.2. Физические методы стимулирования химических превращений | |
| 4.2.3. Катализ | |
| 4.3. Химическое равновесие | |
| 4.3.1. Константа химического равновесия | |
| 4.3.2. Принцип Ле Шателье | |
| 5. ДИСПЕРСНЫЕ СИСТЕМЫ | |
| 5.1. Способы выражения концентрации растворов | |
| 5.2. Свойства разбавленных растворов | |
| 5.3 Растворы электролитов | |
| 5.4. Ионное произведение воды. Водородный показатель | |
| 5.5 Равновесие в гетерогенных системах, произведение растворимости | |
| 6. ГИДРОЛИЗ СОЛЕЙ | |
| 6.1. Произведение растворимости. Примеры решения задач | |
| 7. ЖЕСТКОСТЬ ВОДЫ | |
| 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ | |
| 8.1 Электродные потенциалы и электродвижущие силы | |
| 8.2 Электролиз | |
| 8.3 Коррозия металлов | |
| 9. КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ | |
| 9.1.Основные понятия | |
| 9.2 Симметрия кристаллов. Система кристаллов | |
| 9.3 Кристаллические решетки | |
| 10. СПЛАВЫ | |
| 10.1 Диаграммы состояния металлических систем | |
| ПРИЛОЖЕНИЯ | |
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК |
– Конец работы –
Используемые теги: качестве, учебного, пособия0.064
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: В качестве учебного пособия
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов