рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Використання законів Вант-Гоффа та Рауля до розчинів електролітів
Реферат Курсовая Конспект
Використання законів Вант-Гоффа та Рауля до розчинів електролітів
Використання законів Вант-Гоффа та Рауля до розчинів електролітів - раздел Образование, РОЗЧИНИ Дослідження Осмотичного Тиску, Температур Кипіння Та Замерзан...
Дослідження осмотичного тиску, температур кипіння та замерзання розчинів електролітів свідчать, що ці розчини не підлягають законам Вант-Гоффа та Рауля. Експериментально отримані значення  ,
,  ,
,  для розчинів електролітів завжди були більші значень, розрахованих за формулами Вант-Гоффа та Рауля. Причиною цього є зростання загальної кількості частинок у розчині внаслідок електролітичної дисоціації молекул солей, основ та кислот.
для розчинів електролітів завжди були більші значень, розрахованих за формулами Вант-Гоффа та Рауля. Причиною цього є зростання загальної кількості частинок у розчині внаслідок електролітичної дисоціації молекул солей, основ та кислот.
Властивості розчинів (осмотичний тиск, температура кипіння та замерзання) кількісно залежать тільки від кількості частинок розчиненої речовини і не залежать від їх природи.
Наприклад, у розбавленому розчині  кожна молекула дисоціює на два іони:
кожна молекула дисоціює на два іони:
 ,
,
отже, число частинок у цьому розчині в два рази більше, ніж число розчинених молекул. Для того, щоб закони Вант-Гоффа і Рауля можливо було використати для розбавлених розчинів електролітів, значення концентрації розчиненої речовини потрібно помножити на коефіцієнт  . Цей коефіцієнт має назву ізотонічного або коефіцієнта Вант-Гоффа.
. Цей коефіцієнт має назву ізотонічного або коефіцієнта Вант-Гоффа.
Тоді формули будуть мати наступний вигляд:
 ,
,  ,
,  .
.
Для розчинів неелектролітів ізотонічний коефіцієнт  .
.
Ізотонічний коефіцієнт дорівнює відношенню загального числа часток  у розчині до числа розчинених молекул
у розчині до числа розчинених молекул  :
:
 .
.
Ізотонічний коефіцієнт певним образом пов’язаний зі ступінню дисоціації електроліта 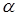 :
:
 ,
,
де  - число молекул, які розпалися на іони;
- число молекул, які розпалися на іони;  - число розчинених молекул.
- число розчинених молекул.
Тоді
 ,
,
де  - кількість іонів, на які розпадається одна молекула електроліта:
- кількість іонів, на які розпадається одна молекула електроліта:

 ;
;

 ;
;

 .
.
Для сильних електролітів у розбавлених розчинах  , тому що всі молекули розпадаються на іони.
, тому що всі молекули розпадаються на іони.
В більш концентрованих розчинах іони взаємодіють між собою, що призводить до результатів, котрі спостерігались би при неповній дисоціації електролітів. У зв’язку з цим ввели величину – уявна ступінь дисоціації електролітів. Ця величина така ж, як ступінь дисоціації слабкого електроліта, позначається літерою 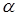 і входить у ті ж рівняння та формули.
і входить у ті ж рівняння та формули.
Приклад 1. Розчин, який містить 1,06 г  у 400 г води, замерзає при температурі – 0,13°С. Визначити уявну ступінь дисоціації солі,
у 400 г води, замерзає при температурі – 0,13°С. Визначити уявну ступінь дисоціації солі,  .
.
Розв’язування.  - сіль, отже це сильний електроліт. Тому для розв’язання задачі потрібно вкористати другий закон Рауля у такій формі:
- сіль, отже це сильний електроліт. Тому для розв’язання задачі потрібно вкористати другий закон Рауля у такій формі:
 ;
;
 ;
;
 г/моль;
г/моль;  ;
;
 .
.
Значення ізотонічного коефіцієнта використовуємо для розрахунку ступіня електролітичної дисоціації. Дисоціація карбонату натрію проходить з утворенням трьох іонів з однієї молекули:
 ;
;
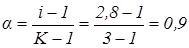 .
.
Уявна ступінь дисоціації a дорівнює 0,9, тобто 90%.
Приклад 2. Уявна ступінь дисоціації  в 0,1 н. розчині дорівнює 0,8.
в 0,1 н. розчині дорівнює 0,8.
Яким буде осмотичний тиск цього розчину при 17°С?
Розв’язування. Хлорид калію – сіль, отже сильний електроліт, при дисоціації однієї молекули утворюється два іони:
 .
.
Обчислюємо ізотонічний коефіцієнт:
 ;
;
 .
.
Тоді осмотичний тиск за законом Вант-Гоффа буде:
 .
.
Для солі  маса еквівалента дорівнює масі 1 моля, тому
маса еквівалента дорівнює масі 1 моля, тому
 моль/л;
моль/л;
 кПа.
кПа.
– Конец работы –
Эта тема принадлежит разделу:
РОЗЧИНИ
Національна гірнича академія України...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Використання законів Вант-Гоффа та Рауля до розчинів електролітів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов