рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Задачі для самостійного розв’язування
Реферат Курсовая Конспект
Задачі для самостійного розв’язування
Задачі для самостійного розв’язування - раздел Образование, РОЗЧИНИ 1. Скільки Грамів Глюкози ...
1. Скільки грамів глюкози  повинно знаходитись у 0,5 л розчину, щоб його осмотичний тиск (при тій же температурі) був таким, як і розчину, в 1 л якого міститься 0,2 г гліцерину
повинно знаходитись у 0,5 л розчину, щоб його осмотичний тиск (при тій же температурі) був таким, як і розчину, в 1 л якого міститься 0,2 г гліцерину  ?
?
Відповідь: 9,0 г.
2. При 25˚С осмотичний тиск розчину, що містить 2,80 г високомолекулярної сполуки в 200 мл розчину, дорівнює 0,70 кПа. Знайти молекулярну масу розчиненої речовини.
Відповідь: 4,95×104 а.о.м.
3. Скільки грамів сахарози 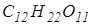 необхідно розчинити в 100 г води, щоб:
необхідно розчинити в 100 г води, щоб:
а) знизити температуру замерзання розчину на 1°С?
б) підвищити температуру кипіння розчину на 1°С?
Відповідь: а) 18,4 г; б) 65,8 г.
4. Розчин, що містить 2,1 г KOH у 250 г води, замерзає при -0,519°С. Знайти ізотонічний коефіцієнт для цього розчину.
Відповідь: 1,86.
5. В рівних кількостях води розчинено в одному випадку 0,5 моль цукру, а в іншому –0,2 моль CaCl2. Температура замерзання цих розчинів однакова. Визначити уявну ступінь дисоціації CaCl2.
Відповідь: 0,75.
Упорядники:
Єгоров Павло Олексійович
Ольга Борисівна Нетяга
Ольга Іванівна Темченко
Інна Геннадіївна Романова
Методичні вказівки до ров’язування задач на тему:
"Розчини" з дисципліни "Хімія"
для студентів усіх спеціальностей
– Конец работы –
Эта тема принадлежит разделу:
РОЗЧИНИ
Національна гірнича академія України...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Задачі для самостійного розв’язування
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов