рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Підвищення температури кипіння та зниження температури замерзання розчинів
Реферат Курсовая Конспект
Підвищення температури кипіння та зниження температури замерзання розчинів
Підвищення температури кипіння та зниження температури замерзання розчинів - раздел Образование, РОЗЧИНИ ...
|
| |||
 | |||
Рис. 3. Графічне зображення закону Рауля
На рисунку 3 пряма  показує зовнішній тиск, рівний
показує зовнішній тиск, рівний  . Чистий розчинник закипає в точці 1 (перетин кривої тиску насиченої пари понад розчинником
. Чистий розчинник закипає в точці 1 (перетин кривої тиску насиченої пари понад розчинником  з прямою зовнішнього тиску
з прямою зовнішнього тиску  ). Цій точці відповідає температура кипіння розчинника
). Цій точці відповідає температура кипіння розчинника  . Розчин закипає в точці 2 (перетин кривої тиску насиченої пари понад розчином
. Розчин закипає в точці 2 (перетин кривої тиску насиченої пари понад розчином  з прямою зовнішнього тиску
з прямою зовнішнього тиску  ). Цій точці відповідає температура кипіння tк. Відрізок Δtк показує, на скільки градусів вища температура кипіння розчину порівняно з температурою кипіння чистого розчинника.
). Цій точці відповідає температура кипіння tк. Відрізок Δtк показує, на скільки градусів вища температура кипіння розчину порівняно з температурою кипіння чистого розчинника.
Рауль установив, що підвищення температури кипіння розбавлених розчинів неелектролітів (Δtк) прямо пропорціонально моляльній концентрації розчину 
 ,
,
де  - коефіцієнт пропорційності, який називається ебуліоскопічною константою, котра являє собою молярне підвищення температури кипіння розчину, який містить 1 моль розчиненої речовини в 1000 г розчинника, тоді при
- коефіцієнт пропорційності, який називається ебуліоскопічною константою, котра являє собою молярне підвищення температури кипіння розчину, який містить 1 моль розчиненої речовини в 1000 г розчинника, тоді при  моль/кг Δtк=Ke.
моль/кг Δtк=Ke.
Температура t0з, що відповідає точці А (перетин кривої тиску насиченої пари понад льодом з кривою тиску насиченої пари понад розчинником), являє собою температуру замерзання чистої води (0°С). Температура  , яка відповідає точці В (перетин кривої тиску насиченої пари понад льодом з кривою насиченої пари понад розчином), являє собою температуру замерзання розчину. Розчин замерзає завжди при температурі більш низькій, ніж температура замерзання чистого розчинника.
, яка відповідає точці В (перетин кривої тиску насиченої пари понад льодом з кривою насиченої пари понад розчином), являє собою температуру замерзання розчину. Розчин замерзає завжди при температурі більш низькій, ніж температура замерзання чистого розчинника.
Рауль установив, що зниження температури замерзання розчину  прямо пропорціонально моляльній концентрації розчину
прямо пропорціонально моляльній концентрації розчину  :
:
 ,
,
де  – коефіцієнт пропорційності, який називається кріоскопічною константою, котра являє собою молярне зниження температури замерзання розчину (
– коефіцієнт пропорційності, який називається кріоскопічною константою, котра являє собою молярне зниження температури замерзання розчину ( =1 моль/кг,
=1 моль/кг,  ).
).
 і
і  залежать від властивостей розчинника та не залежать від властивостей розчиненної речовини.
залежать від властивостей розчинника та не залежать від властивостей розчиненної речовини.
Вимірювання зниження температури замерзання розчину, підвищення температури кипіння дає можливість визначити молярну масу розчиненої речовини.
Для цього моляльну концентрацію виражаємо співвідношенням
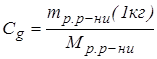 .
.
Коли відома маса розчиненої речовини ( ) і маса розчинника (
) і маса розчинника ( ), тоді масу речовини, розчиненої у 1 кг розчинника (
), тоді масу речовини, розчиненої у 1 кг розчинника ( ), знаходять з пропорції
), знаходять з пропорції
 –
– 
 – 1000 г
– 1000 г
 ,
,
тоді
 .
.
Внаслідок цього закон Рауля можна записати так:
 ;
;
 .
.
Приклад 1. Вирахувати, при якій температурі замерзає розчин, який містить 816 г глюкози  у 2 л води.
у 2 л води.
Розв’язування. Скориставшись законом Рауля:
 ,
,
знаходимо значення  з таблиці кріоскопічних та ебуліоскопічних постійних для різних розчинників
з таблиці кріоскопічних та ебуліоскопічних постійних для різних розчинників
 г/моль;
г/моль;
 г;
г;
 ;
;
 .
.
Таким чином, розчин замерзає при температурі –4,2°С.
Приклад 2. При розчиненні 10 г речовини в 400 г води одержуємо розчин, який замерзає при  °С. Вирахувати молярну масу рочиненої речовини.
°С. Вирахувати молярну масу рочиненої речовини.
 ;
;
 ;
;

 г/моль.
г/моль.
Приклад 3. При розчиненні 6,5 г неелектроліта в 200 г диетилового ефіру  температура кипіння підвищилась на 0,453°С. Визначити молярну масу розчиненої речовини.
температура кипіння підвищилась на 0,453°С. Визначити молярну масу розчиненої речовини.
Розв’язування. Ця задача розв’язується аналогічно попередній:
 ;
;
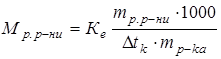 ;
;
 г/моль.
г/моль.
– Конец работы –
Эта тема принадлежит разделу:
РОЗЧИНИ
Національна гірнича академія України...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Підвищення температури кипіння та зниження температури замерзання розчинів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?


 1 2
1 2 





Новости и инфо для студентов