рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Приготування розчинів
Реферат Курсовая Конспект
Приготування розчинів
Приготування розчинів - раздел Образование, РОЗЧИНИ Для Розв’Язування Задач Даного Розділу Необхідно Знати: ...
Для розв’язування задач даного розділу необхідно знати:
1. Що таке розчин?
2. Що має назву розчинника і розчиненої речовини?
3. Яка величина храктеризує склад розчину?
4. Визначення поняття “процентна” концентрація розчину.
5. Визначення поняття “молярна” концентрація розчину.
6. Чим відрізняється поняття “молярна” і “моляльна” концентрації розчинів?
7. Що таке титр розчину?
Тільки після твердого і ясного засвоєння всіх пойменованих понять можна приступати до розв’язування задач.
Розглянемо відповіді на ці питання.
Систему з двох (або більше) речовин, в якій одна (або декілька) речовин подрібнено і розподілено в іншій, називають дисперсною. Речовини, що утворюють в дисперсній системі суцільну фазу, називаються дисперсійним середовищем, а розподілені в середовищі – дисперсною фазою. Якщо дисперсійне середовище – рідина, то його називають розчинником, а дисперсну фазу – розчиненою речовиною. Наприклад, розчин цукру у воді: розчинник (дисперсійне середовище) – вода, розчинена речовина – цукор. Однорідні гомогенні системи називаються істинними розчинами, а часто просто розчинами. Ступінь подрібнення в справжньому (істинному) розчині молекулярна чи іонна, тобто, лінійні розміри часток не перевищують розмірів окремих молекул або іонів. Склад розчину характеризується його концентрацією. Концентрацією розчину називається вміст розчиненої речовини в певній масовій чи об’ємній кількості розчину. Існують різноманітні способи вираження концентрації розчинів, найважливіші серед яких:
процентна концентрація Ср;
молярна концентрація См;
нормальна концентрація СN;
моляльна концентрація Сg;
титр Т.
Перше ніж розглядати різні способи вираження складу розчинів, введемо ряд загальних позначень:
 р-ну – маса розчину, г;
р-ну – маса розчину, г;
 р-ну – маса одного літра розчину, г;
р-ну – маса одного літра розчину, г;
 р-ка – маса розчинника, г;
р-ка – маса розчинника, г;
 р.р-ни – маса розчиненої речовини, г;
р.р-ни – маса розчиненої речовини, г;
 р.р-ни – маса розчиненої речовини в 1 л розчину, г;
р.р-ни – маса розчиненої речовини в 1 л розчину, г;
 р.р-ни (1 кг) – маса розчиненої речовини, що припадає на 1 кг розчинника;
р.р-ни (1 кг) – маса розчиненої речовини, що припадає на 1 кг розчинника;
 р.р-ни – маса моль розчиненої речовини, г/моль;
р.р-ни – маса моль розчиненої речовини, г/моль;
 – кількість еквівалентів розчиненої речовини;
– кількість еквівалентів розчиненої речовини;
 – кількість еквівалентів розчиненої речовини в 1 л розчину;
– кількість еквівалентів розчиненої речовини в 1 л розчину;
 – кількість моль розчиненої речовини;
– кількість моль розчиненої речовини;
 – кількість моль розчиненої речовини в 1 л розчину;
– кількість моль розчиненої речовини в 1 л розчину;
 – густина розчину, г/мл;
– густина розчину, г/мл;
 – об’єм розчину, мл або л;
– об’єм розчину, мл або л;
 - маса еквівалента, г/моль.
- маса еквівалента, г/моль.
Процентна концентрація показує, скільки грамів розчиненої речовини знаходиться у 100 г розчину або скільки процентів від маси розчину припадає на долю розчиненої речовини.
Молярна концентрація дорівнює кількості моль розчиненої речовини, що міститься в 1 л розчину.










 |  | ||









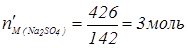
1л 1л




 3М Na2SO4
3М Na2SO4
Рис. 1. Визначення молярної концентрації розчину в загальному вигляді
Конкретну молярну концентрацію розчину можна записати двома способами. Наприклад, якщо молярна концентрація розчину  дорівнює 3:
дорівнює 3:
– См  – 3 моль/л;
– 3 моль/л;
– 3М розчин  .
.
Нормальна концентрація розчину дорівнює кількості моль еквівалентів розчиненої речовини, що міститься в 1 л розчину.





























1 л  1 л
1 л 



Рис. 2. Визначення нормальної концентрації розчину в загальному вигляді
Моляльна концентрація розчину дорівнює кількості моль речовини, розчиненої в 1000 г розчинника. Від молярної концентрації моляльна відрізняється тим, що перша розраховується на об’єм розчину (1 л), а остання – на масу розчинника (1000 г).
Підкреслюємо: моляльна концентрація – єдиний спосіб вираження складу розчину, що відноситься до чистого розчинника
 ,
,
 .
.
Приклад. 568 г  розчинено в 2 л води. Обчислити моляльну концентрацію розчину
розчинено в 2 л води. Обчислити моляльну концентрацію розчину
 л
л  г/мл;
г/мл;
 кг;
кг;
 г;
г;
 г/моль;
г/моль;
 моль.
моль.
Титр (Т) розчину дорівнює кількості грамів розчиненої речовини в 1 мл розчину.
Наприклад:  г/мл. Це означає, що в 1 мл розчину знаходиться 0,0021 г
г/мл. Це означає, що в 1 мл розчину знаходиться 0,0021 г  .
.
– Конец работы –
Эта тема принадлежит разделу:
РОЗЧИНИ
Національна гірнича академія України...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Приготування розчинів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов