Образование молекул из возбужденного состояния атомов
Образование молекул из возбужденного состояния атомов.
Теория гибридизации.
Основные положения теории гибридизации:Гибридизация с участием неподеленных электронных пар
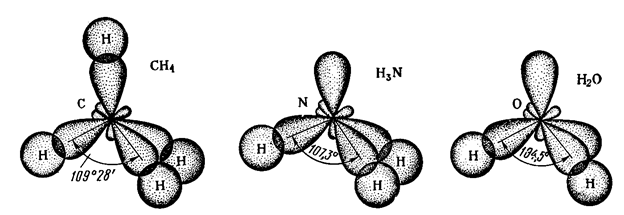
Перекрывание орбиталей в молекулах CH4, NH3, H2O
Гибридизация в молекулах с кратными связями (частичная гибридизация).
Бензол

s-Связи в молекуле(sp2) p-электронные облака в молекуле бензола

p-Связи в молекуле бензола
Ионная связь.
Электроны в ионных соединениях в высшей степени локализованы, т.е. принадлежат одному из атомов.Это галогениды щелочных и отчасти щелочноземельных… Ионная связь ненаправлена и ненасыщаема. При стандартных условиях соединения с…Металлическая связь.
Внешние электроны в металле не связаны с какими-либо конкретными атомами, а перемещаются по всей конденсированной фазе достаточно свободно. Металл можно рассматривать как плотно упакованную структуру из катионов, связанных друг с другом «электронным газом». Химическая связь в металлах не локализована и не направлена.
В металлах небольшое число электронов одновременно связывает большое число ядер.
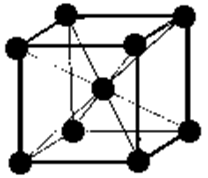
|
| Кубическая объемно-центрированная решетка атома лития. |
Наличие делокализованных электронов связано с ненаправленным характером химических связей, поэтому атомы металлов легко перемещаются из одного равновесного положения в другое, что обусловливает ковкость этих веществ.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
BaCl2 + Na2SO4 = BaSO4↓ + 2 NaCl - реакция обмена SnCl2 + FeCl3 → FeCl2 + SnCl4 - ОВР Sn2+ +2Cl‾ + Fe3+ + 3Cl‾ → Fe2+ + 2Cl‾ + Sn4+ + 4Cl‾Классификация ОВР.
Zn + CuSO4 = ZnSO4 + Cu H2 + Br2 = 2HBr 2) Реакции диспропорционирования (самоокисления - самовосстановления):Составление уравнений ОВР методом ионно- электронного баланса.
При составлении уравнений ОВР следует придерживаться определенной последовательности.